Artigo
|
|
| Vestígios do derrame de petróleo de 2019: avaliação da presença de hpa e btex em produtos de pesca Echoes of the oil spill of 2019: assessment of the presence of pah and btex in products from fishing |
|
Crislaine F. BertoldiI; Rafael G. DolattoI I. Departmento de Química, Universidade Federal do Paraná, 81531-980 Curitiba - PR, Brasil Recebido: 01/04/2024 *e-mail: mtgrassi@ufpr.br The 2019 oil spill in Brazil caused widespread contamination in the Brazilian coast, posing risks to both animal and human health through seafood consumption. Therefore, this study aimed to evaluate seafood samples from different locations impacted by the oil spill. For this purpose, 44 samples underwent extraction processes for the determination of polycyclic aromatic hydrocarbons (PAH) and benzene, toluene, ethylbenzene, and xylene (BTEX). The BTEX compounds were undetected above the limit of detection (LOD) of 0.02 µg g-1 of wet mass. The LOD and limit of quantification (LOQ) for the PAH were 2 and 5 ng g-1, respectively. The range of recovery of PAH obtained from spiking was 39 ± 15.8 to 84 ± 5%. The concentration of PAH in the samples ranged from < LOQ to 17.5 ng g-1. Results suggested higher contamination levels in samples collected in Rio de Janeiro, with quantifications for 11 of the evaluated PAH. Benzo[a]pyrene and dibenzo[a,h]anthracene, both potentially carcinogenic, were found in 32 and 14% of samples, respectively. Therefore, additional coastal monitoring is advised to ensure seafood safety, given the potential PAH carcinogenicity, which could strain the Brazilian public health system. INTRODUÇÃO A contaminação do mar com petróleo bruto possui impactos ambientais diretos na biodiversidade marinha e sobre os ecossistemas costeiros e de acordo com as estimativas atuais, o volume anual de petróleo bruto que aporta nos oceanos devido a atividades antrópicas e infiltrações naturais pode alcançar 8,3 milhões de toneladas.1,2 A problemática da contaminação por petróleo está relacionada ao seu elevado potencial poluidor, uma vez que é composto por misturas complexas de compostos orgânicos, principalmente hidrocarbonetos, como por exemplo hidrocarbonetos policíclicos aromáticos (HPA) e benzeno, tolueno, etilbenzeno e xilenos (BTEX). Estes compostos são de preocupação constante em monitoramentos ambientais, visto que possuem características de bioacumulação e podem desencadear efeitos carcinogênicos.2-5 Desta forma, atividades pesqueiras no mar possuem especial atenção, uma vez que vazamentos de petróleos são eventos que podem afetar diretamente estas atividades, oferecendo assim um risco à saúde humana devido a possibilidade de ingestão de alimentos contaminados.6 Além disso, a contaminação do mar por vazamentos e/ou derramamentos de petróleo gera impactos econômicos locais devido principalmente à redução das atividades de pesca e também turísticas na região afetada.7,8 No Brasil, o último acidente por contaminação de petróleo com registro oficial ocorreu em 30 de agosto de 2019 até janeiro de 2020, atingindo 11 estados, 120 municípios e 724 localidades, entre as regiões Nordeste e Sudeste, totalizando cerca de 2.900 quilômetros (km) do litoral brasileiro.9 Neste período, manchas de petróleo bruto atingiram a costa do Brasil e os impactos deste desastre ainda estão sendo avaliados.10,11 Entre estes impactos, estão os danos socioeconômicos associados principalmente à população com atividade de pesca como principal fonte de subsistência.12 Assim, devido ao potencial impacto de contaminação da biota e a cadeia alimentar por HPA e BTEX, alguns estudos foram realizados para compreender o impacto do derramamento de 2019. No mesmo ano, amostras de óleo bruto, água, bivalves e peixes da costa nordeste do Brasil, entre os estados de Alagoas e Sergipe, foram avaliadas por Soares et al.13 em termos de espécies metálicas, HPA e BTEX. Os autores relataram que as concentrações totais de HPA nas amostras de água do mar variaram na faixa entre < 0,01 a 275,49 ng L-1, de 14,28 a 32,06 ng g-1 por amostra de peixe. Outro estudo, realizado por Choueri et al.,7 investigou a contaminação por HPA e as respostas ecotoxicológicas na biota aquática e em amostras de sedimentos coletadas 17 e 24 meses após o pico de contaminação do petróleo na região costeira de Pernambuco. Os autores apontam que os níveis de HPA e a toxicidade determinada não se mostraram significativos em relação ao óleo derramado e os efeitos biológicos foram similares a locais não afetados pelo evento. Magalhães et al.11 também avaliaram a presença de HPA em tecidos de 34 espécies de peixes e mariscos durante o período de novembro de 2019 a janeiro de 2020 na costa de Pernambuco. De acordo com o estudo, foram identificados HPA em concentrações entre 8,71 a 418 ng g-1, em que naftalenos foram os compostos majoritariamente encontrados. O estudo ressalta que embora menos de 3% das amostras tenham apresentado níveis de contaminação preocupantes à saúde humana, mais estudos precisam ser elaborados para melhor elucidar a contaminação e impacto a longo prazo dos produtos da cadeia alimentar. Portanto, diante do contexto delineado quanto à possível contaminação de alimentos destinados ao consumo humano, o presente estudo teve por objetivo avaliar a presença residual de 16 HPA prioritários e 5 BTEX em diferentes produtos oriundos da pesca e aquicultura, os quais foram coletados após transcorridos 30 meses do aparecimento das manchas de petróleo na costa brasileira em 2019. Além disso, também se realizou uma análise com as concentrações dos contaminantes encontrados e os níveis de preocupação estabelecidos pela Agência Nacional de Vigilância Sanitária (ANVISA)14 para produtos direcionados à alimentação humana, para compostos carcinogênicos genotóxicos em relação aos HPA.
PARTE EXPERIMENTAL Padrões e reagentes Os solventes acetonitrila, hexano e metanol foram todos de grau cromatográfico (HPLC) das marcas Sigma-Aldrich (Saint Louis, Estados Unidos), Panreac (Castellar del Vallès, Espanha), JT Baker (Cidade do México, México) ou similares. Para o estudo, foram empregados padrões analíticos de alta pureza (> 95%) de 5 BTEX (benzeno, tolueno, etilbenzeno, m- + p-xileno e o-xileno), de 16 HPA prioritários (naftaleno, acenaftileno, acenafteno, fluoreno, fenantreno, antraceno, fluoranteno, pireno, benzo[a]antraceno, criseno, benzo[b]fluoranteno, benzo[k]fluoranteno, benzo[a]fluoranteno, benzo[a]pireno, indeno[1,2,3-cd]pireno, dizenzo[a,h]antraceno, benzo[g,h,i]pireleno), de 5 padrões de HPA deuterados (acenafteno-2H10, criseno-2H12, fenantreno-2H10, naftaleno-2H8 e perileno-2H12) e 1 padrão interno deuterado (p-Terfenil-2H14), todos da marca Merck/Sigma-Aldrich (Saint Louis, Estados Unidos). As soluções estoques dos padrões BTEX e PAH foram preparadas em metanol e diclorometano, respectivamente, em concentração de 80,0 mg L-1. Estas foram mantidas no freezer (–18 ºC) até o momento do preparo das soluções intermediárias e de trabalho. Local de estudo e amostragem As amostras de pescado foram adquiridas de pescadores locais, aproximadamente dois anos e meio após o surgimento das manchas de petróleo em 2019. Os locais de coleta foram: regiões costeiras da Bahia, Pernambuco e Rio de Janeiro. Após a coleta, o tecido muscular das amostras foi liofilizado e encaminhado para o Laboratório de Análises Ambientais do Grupo de Química Ambiental (GQA) da Universidade Federal Paraná, para determinação de BTEX e HPA. Ao total foram analisadas 44 amostras. A relação das amostras avaliadas, bem como o código e local de coleta estão descritos na Tabela 1.
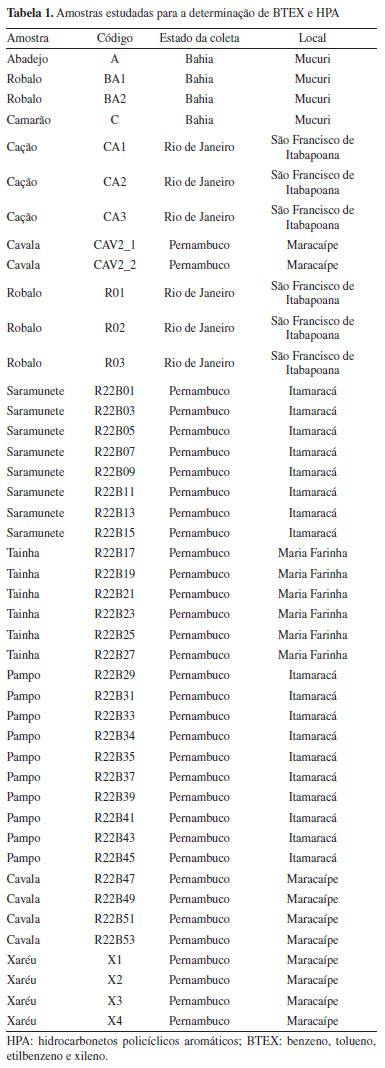
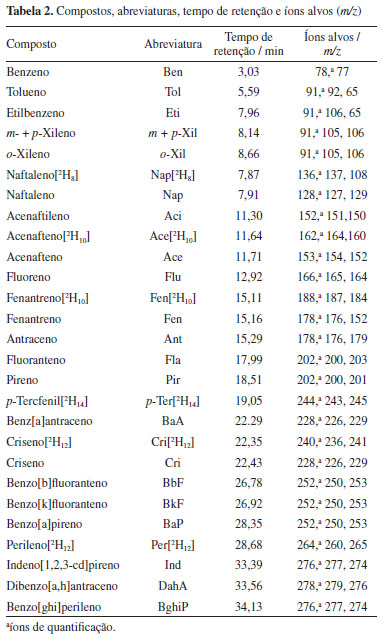
Extração de BTEX e HPA As concentrações de BTEX foram determinadas nas amostras de pescado empregando condições modificadas de extração descritas no método EPA Method 8265.15 Para a extração, 1 g da amostra previamente liofilizada em liofilizador Liobras L101 (São Carlos, Brasil) e triturada foi transferida para vials headspace de 20 mL. Em seguida, 10 mL de metanol foi adicionado a amostra. O vial foi fechado com tampa rosqueável contendo septo em politetrafluoretileno (PTFE) e em seguida a amostra foi submetida a agitação em vortex Ika modelo vortex 1 (Staufen, Alemanha) por 1 min e uma alíquota de 200 µL do extrato foi transferida para outro vial de headspace e o volume completado para 5 mL com água ultrapura purificada em sistema Millipore Simplicity (Molsheim, França). O vial foi fechado e encaminhado para quantificação com a técnica de cromatografia gasosa acoplada a espectrometria de massas com injeção por headspace (HS-GC-MS), de acordo com os parâmetros instrumentais descritos na seção "Determinação dos HPA e BTEX por GC-MS". Os HPA foram extraídos das amostras empregando o método de saponificação. A saponificação com uma base é sugerida para quebrar componentes como proteínas e lipídios, nos quais os HPA podem ser adsorvidos, para posterior separação usando solventes orgânicos.16 O método empregado foi baseado no protocolo de Da Silva et al.17 Para a extração com saponificação, alíquotas de 0,25 g de amostra liofilizadas e maceradas foram adicionadas em um tubo de vidro de 100 mL juntamente com 100 µL dos padrões sub-rogados em concentração de 200 ng g-1. No frasco, foram adicionados 4,0 mL de solução saturada de hidróxido de potássio (KOH), preparada em metanol, na concentração 2 mol L-1 e 10 mL de hexano. Posteriormente, o frasco foi vedado e submetido a aquecimento em banho-maria Fisatom 550 (São Paulo, Brasil) por 1 h a 70 ºC. Finalizado o processo, após o resfriamento, uma alíquota de 6 mL da fase orgânica foi filtrada em filtro de PTFE hidrofílico de porosidade de 0,45 µm. A purificação (clean-up) do extrato foi realizada em uma coluna de vidro com dimensões de 115 × 15 mm contendo 500 mg de C18. A coluna foi empacotada com 4 mL de diclorometano e condicionada com 4 mL de diclorometano e hexano (1:1). Em seguida, 6 mL da amostra foi transferido para a coluna e eluída com 10 mL da mistura diclorometano e hexano. Consecutivamente, 10 mL do eluato foi coletado em tubo de vidro de 12 mL e concentrado em evaporador rotativo a vácuo Christ, modelo RVC 2-18 CD Plus (Osterode am Harz, Alemanha) operado a 60 ºC em rotação de 1500 rpm. O extrato foi solubilizado com 1000 µL de solução de p-tercfenil-D14 preparado em hexano, na concentração de 100 µg L-1 e analisado por GC-MS. Determinação dos HPA e BTEX por GC-MS A separação, identificação e quantificação dos BTEX e HPA foram realizadas em um cromatógrafo a gás Shimadzu QP2010 Plus (Kyoto, Japão) equipado com uma coluna capilar analítica Phenomenex ZB-5ms (Califórnia, Estados Unidos) 30 m × 0,25 mm × 0,25 µm acoplado a espectrômetro de massa, TQ8040 e um amostrador automático, Combi Palm Shimadzu AOC-5000 Plus. O equipamento foi operado com hélio analítico de alta pureza 99,999% como gás de arraste em vazão constante, fornecido pela White Martins (Paraná, Brasil). As determinações de BTEX foram realizadas por HS-GC-MS. Neste procedimento, o vial contendo a amostra é aquecido (60 ºC) e agitado (250 rpm) durante 5 min. O aquecimento promove a volatilização dos analitos, deslocando o equilíbrio para a fase gasosa, localizada no volume morto do frasco ou headspace. Por fim, uma seringa cromatográfica aquecida (60 ºC) e controlada por amostrador automático perfura o septo do frasco, coletando apenas um volume pré-determinado da fase gasosa (500 µL) e injetando a amostra no GC-MS para quantificação. O instrumento foi operado usando 1,00 mL min-1 de gás de arraste com vazão constante, injeção no modo splitless a 180 ºC sem pulso de pressão. A coluna foi mantida a 35 ºC por 5 min, seguida de aquecimento a 10 ºC min-1 e por fim, um gradiente de 30 ºC min-1 a 200 ºC, sendo mantido por 2 min. A linha de transferência e a fonte de íons foram mantidas a 250 ºC. Para HPA, a injeção foi realizada empregando 1 µL do extrato em modo splitless a 270 ºC. O programa de aquecimento foi de 40 ºC por 2 min, aumentado a uma taxa de 50 ºC min-1 a 80 ºC, depois aumentado de 10 ºC min-1 a 240 ºC (2 min de espera), de 240 a 260 ºC a uma taxa de 4 ºC min-1 (5 min de espera) e por fim, a uma taxa de 20 ºC min-1 a 300 ºC (7 min de espera) (tempo de execução = 39,8 min). A linha de transferência e da fonte de ionização foram mantidas em temperatura de 280 e 230 ºC, respectivamente. As determinações de BTEX e HPA foram realizadas em modo de monitoramento seletivo de íons, SIM. A Tabela 2 apresenta as informações de abreviatura, tempo de retenção e íons alvo dos analitos investigados.18
Curvas analíticas e avaliação do desempenho do método As curvas analíticas para BTEX foram elaboradas em triplicata, utilizando o método de padronização externa, a partir de soluções intermediárias de BTEX em concentrações de 500 e 2500 µg L-1. A curva analítica foi preparada em 5,00 mL de soluções aquosas em cinco níveis de concentração, contendo 4% de metanol para respeitar o teor de solvente no processo de extração dos BTEX: 1,0; 5,0; 25,0; 50,0; e 75,0 μg L-1. Ressalta-se que esses padrões foram preparados diretamente em frascos para headspace de 20 mL, com septo de PTFE não perfurado. Para avaliar a precisão e exatidão do protocolo de extração de BTEX, foram realizados ensaios de recuperação em pescado liofilizado. Em 1 g de pescado foi realizado fortificação com 62,5 µL de solução padrão de BTEX (80 mg L-1), seguida da adição de 10 mL de metanol (MeOH), proporcionando concentração de 5,0 µg g-1. O frasco foi fechado e submetido a agitação por vórtex por 1 min e após a separação de fase, uma alíquota de 200 µL foi transferida para outro vial e o volume completado para 5 mL com água ultrapura. As curvas de HPA foram preparadas em hexano, em sete níveis de concentração: 5,0; 10,0; 25,0; 50,0; 75,0; 125,0 e 250,0 μg L-1. O controle e garantia de qualidade (QA/QC) dos protocolos de extração para os HPA incluiu a adição de padrões sub-rogados em concentração de 200 ng g-1 em todas as extrações, além de ensaios em branco (n = 5) e análise dos solventes utilizados. Adicionalmente, foi realizado ensaio de recuperação em triplicata com a amostra B47 com os HPA em concentração de 200 ng g-1. A fortificação foi realizada com 100 µL de solução dos HPAs em concentração de 0,50 mg L-1, resultando na concentração de 200 ng g-1. Os limites de detecção (LOD) e quantificação (LOQ) foram calculados com base nos parâmetros das curvas analíticas: 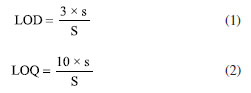 onde s é estimativa do desvio padrão dos interceptos e S a média das inclinações. De posse desses valores, os limites considerando a massa das amostras foram estimados com base no padrão de menor concentração das curvas analíticas. Conversão da concentração em massa seca para massa úmida Segundo a literatura,19 a carne de peixe é composta por 66-81% de água, 16-21% de proteína, 1,2-1,5% de minerais, 0,2-25% de gordura e 0-0,5% de carboidratos. Neste estudo, entre as espécies estudadas, o teor de umidade também se encontra na faixa mencionada.20-24 Portanto, para este trabalho foi considerada umidade de 75% para todas as amostras, com o objetivo de converter os valores obtidos de concentração em massa seca para massa úmida, tornando possível a comparação dos dados obtidos com os dados de concentrações de níveis preocupantes disponibilizados pela ANVISA.14 O cálculo de conversão foi realizado considerando a equação abaixo: 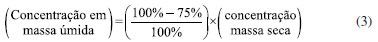
RESULTADOS E DISCUSSÃO Curvas analíticas e ensaios de recuperação para HPA e BTEX A determinação dos HPA foi realizada por meio de curvas analíticas instrumentais com sete níveis de concentração na faixa entre 5-250 µg L-1, em que os coeficientes de determinação obtidos foram entre 0,9956 e 0,9996. Em seguida, por meio da curva analítica, foram calculados os LOD e LOQ, sendo LOD de 2 ng g-1 e LOQ de 5 ng g-1. Foram obtidos valores médios de recuperação de 77 ± 1,2% para criseno-D12 e 76 ± 2,6% para perileno-D12, com incertezas (RSD) inferiores a 22%. Deste modo, a menor recuperação alcançada foi de 39 ± 15,8% para o acenaftileno e a maior de 84 ± 5% para o benzo[b]fluoranteno. Os dados de recuperação estão demonstrados na Tabela 3.
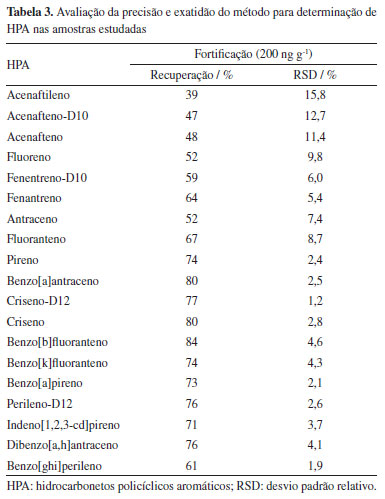
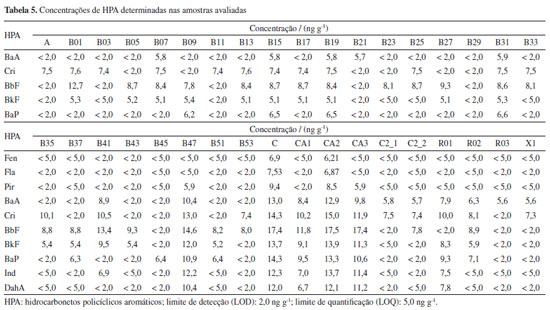
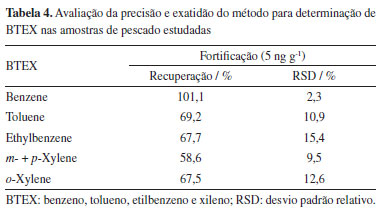
Portanto, por meio dos dados obtidos com os ensaios de recuperação, sugere-se que o método empregado possui potencial para ser utilizado na determinação de HPA em amostras de pescado com maior teor de gordura, como as analisadas neste estudo, como por exemplo o pampo, que pode ter até 14% de teor de gordura, enquadrando-se na classe de peixes gordurosos (teor de gordura acima de 10%).25 Para os ensaios de BTEX, os coeficientes de determinação obtidos foram entre 0,9993 e 0,9849 e a partir dos ensaios de recuperação, foram obtidas recuperações na faixa de 58,6 ± 9,5 e 101.1 ± 2,3%, demonstrados na Tabela 4. BTEX e HPA em amostras de pescado Conforme os dados obtidos neste estudo, os compostos BTEX não foram detectados nas amostras analisadas, considerando o limite de detecção de 0,02 µg g-1 de massa úmida. Em relação à determinação de HPA, entre as 44 amostras analisadas, 36 indicaram a presença dos compostos aromáticos avaliados. A relação da concentração de cada HPA encontrado nas amostras está demonstrada nas Tabelas 4 e 5. Os HPA foram quantificados a partir do fenantreno, para as amostras CA2 e C, com concentrações de 6,21 e 6,90 ng g-1 respectivamente. A concentração máxima de HPA encontrada foi de 17,5 ng g-1 para a amostra CA2. Os resultados sugeriram maior contaminação para as amostras C, da Bahia, CA1, CA2 e CA3, amostradas no Rio de Janeiro e a amostra B47, obtida em Pernambuco, com maiores concentrações dos contaminantes e também pela maior frequência de quantificações de 11 HPA avaliados.
Estes resultados são similares àqueles descritos por Magalhães et al.,11 que também avaliaram a contaminação de amostras de pescado pelo derramamento de petróleo em 2019 na costa brasileira, identificando contaminações em uma faixa de concentração de 8,71 a 418 ng g-1. Conforme o estudo, no geral, maiores concentrações foram encontradas para os HPA de menor massa molecular como o naftaleno, condição esta que difere parcialmente dos dados obtidos neste estudo. Em outro estudo, realizado por De Melo et al.,26 com amostras de pescado de diferentes regiões do Brasil em 2019, os HPA benzo[a]antraceno, benzo[a]pireno, ebenzo[b]fuoranteno foram os HPA mais frequentes, variando de < LOQ (5,0 ng g-1) a 113 ng g-1. Apesar da similaridade de contaminação para algumas amostras avaliadas, observa-se que a maior concentração encontrada nos estudos realizados por Magalhães et al.11 e De Melo et al.26 foram superiores às encontradas no presente trabalho. Entretanto, é importante ressaltar que o presente estudo avaliou amostras coletadas 30 meses após o acidente de 2019 e que, portanto, os resultados sugerem presença residual destes compostos em amostras de pescado. Também é importante salientar que neste estudo, as amostras coletadas na região Nordeste do país apresentaram concentrações menores de HPA, em média, quando comparadas às amostras coletadas no Norte Fluminense. Embora, no geral, todas as espécies coletadas façam parte de nível trófico elevado, com tendência a acumulação de contaminantes, apenas no Norte Fluminense foram avaliados os cações, da classe dos elasmobrânquios. Segundo Martins et al.,27 os elasmobrânquios, uma subclasse de peixes caracterizados por possuírem cartilagem no lugar de ossos, tendem a acumular altos níveis de contaminantes devido as posições tróficas mais elevadas, atuando como predadores meso e de ápice, além de serem mais longevos. Estes autores estudaram uma espécie de raia viola e observaram altas concentrações de HPA em músculos destes animais, indicando uma contaminação crônica nos indivíduos estudados. Em outro estudo também foi observada a transferência materna de HPA, identificando principalmente o benzo[b]fluoranteno como o composto com maior taxa de transferência. Mesmo considerando que são espécies diferentes de elasmobrânquios, estes resultados sugerem que as concentrações mais altas nas amostras de cação podem estar relacionadas às espécies, mas também à classe de compostos, do que apenas a uma contaminação pontual.28 Em outros trabalhos ao redor do mundo, também é possível encontrar concentrações similares, e em locais onde a atividade industrial relacionada a petróleo é intensa, a concentração mostra-se ainda maior. Por exemplo, em amostras de peixes coletadas em uma área com intensa atividade petroquímica no Oriente Médio (Al-Jubail, Arábia Saudita), autores29 relataram níveis de HPA de 0,29 ng g-1 para o benzo[a]pireno e 158,39 ng g-1 para o acenafteno. Outro trabalho realizado por Ju et al.6 também avaliou a presença de HPA em diferentes espécies de peixes, onde os valores variaram de 43,0 ± 11.3 a 20,0 ± 5,8 ng g-1, entretanto, benzo[a]pireno não foi detectado nas amostras, sendo este um composto com potencial cancerígeno entre os HPA. Em geral, a rápida depuração e biotransformação de alguns HPA em produtos do mar pode resultar no seu desaparecimento ou redução nas concentrações. Avaliação de risco No Brasil, após o acidente do derramamento de óleo de 2019, a ANVISA14 elaborou uma nota técnica a respeito dos riscos à saúde humana decorrentes do consumo de pescados oriundos das praias contaminadas por óleo cru na região Nordeste do Brasil. Nesta nota está descrito o nível de preocupação para compostos carcinogênicos genotóxicos em relação aos HPA. Desta forma, por meio dos dados de concentração de nível preocupante expostos pela ANVISA14 e por Magalhães et al.,11 foi possível realizar uma análise a respeito do nível de contaminação das amostras avaliadas neste projeto, demonstrada na Tabela 6.
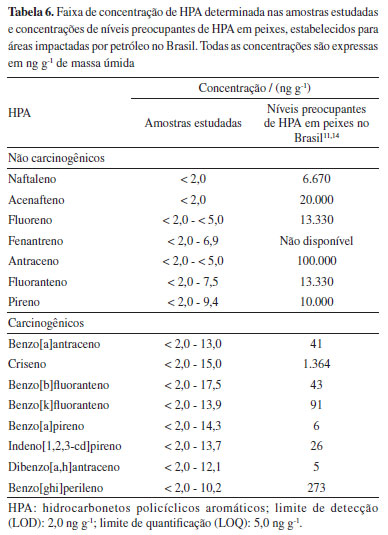
Por meio dos resultados obtidos foi observado que entre todas as amostras analisadas, as concentrações de HPA pertencentes ao grupo não carcinogênicos e não genotóxicos foram inferiores aos níveis de preocupação estabelecidos para eventos de derramamento de óleo no Brasil, segundo a ANVISA.14 Por outro lado, para os HPA pertencentes ao grupo carcinogênico genotóxico foram identificados dois compostos acima do limite estabelecido de 6 ng g-1 para o benzo[a]pireno (em 32% das amostras) e 5 ng g-1 para o e dibenzo[a,h]antraceno (em 14% das amostras). Assim, estes dados apontam, que mesmo sendo encontrados apenas 2 dos compostos com potencial cancerígeno, a presença de ambos ocorreu em aproximadamente um terço das amostras analisadas, o que pode servir de alerta para novas análises destes contaminantes. Neste contexto, entre as amostras avaliadas, a presença de HPA em maiores concentrações foi determinada para aquelas coletadas na região de São Francisco de Itabapoana (Rio de Janeiro), sugerindo maior contaminação do local quando comparadas aos outros locais amostrados. Neste ponto, destacam-se as menores concentrações de HPA nas amostras coletadas nas regiões de Pernambuco, sendo: Itamaracá, Maria Farinha e Maracaípe. Este fato sugere para um menor impacto destas regiões com contaminações oriundas de petróleo, principalmente durante o período de coleta. A região Norte Fluminense também pode estar influenciada pela extração de petróleo em plataformas da Bacia de Campos, além da influência de inúmeras atividades antrópicas, por ser uma região com elevada densidade populacional e, como citado anteriormente, pela contaminação crônica identificada principalmente em elasmobrânquios. Neste contexto, é importante ressaltar que o cação, pouco conhecido como sendo uma espécie de tubarão, é um dos peixes mais consumidos no Brasil e no mundo.29
CONCLUSÕES O presente trabalho teve como objetivo, avaliar a contaminação de alimentos destinados a população, coletados em diferentes regiões do Brasil, afetadas pelo derramamento de petróleo em 2019. Assim, os resultados deste estudo indicaram que as amostras de pescado possuem contaminação por compostos de HPA, indicando que mais estudos precisam ser realizados para melhor compreender o impacto da contaminação da costa brasileira devido a derramamento de petróleo e assim tomar medidas em relação à segurança alimentar de alimentos provindos de regiões contaminadas. Assim, em conformidade com os dados obtidos, maiores concentrações de HPA foram determinadas para os compostos classificados como cancerígenos, benzo[a]pireno em 32% e dibenzo[a,h]antraceno em 14% das amostras. Além disso, é importante apontar que uma das espécies que apresentou potencial de contaminação é o cação, pouco conhecido como uma espécie de tubarão, e é um dos peixes com amplo consumo no Brasil e no mundo. Em relação ao estudo, existem limitações que devem ser consideradas em trabalhos futuros, como melhorar o método de extração, a fim de aumentar os níveis de recuperação para os HPA. Também se sugere que mais estudos de monitoramento precisam ser realizados na costa brasileira, para assegurar a qualidade do alimento oriundo do mar que será disponibilizada à população, visto que o potencial cancerígeno de alguns HPA pode representar também um desafio adicional para o sistema público de saúde brasileiro.
AGRADECIMENTOS Os autores agradecem o apoio financeiro recebido do Instituto Nacional de Ciências e Tecnologias Analíticas Avançadas (INCTAA, processo CNPq 465768/2014-8, Programa Ciência do Mar, chamada emergencial em resposta ao derramamento de óleo ocorrido em 2019). M. C. C. agradece ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, proc. 316060/2023-2 PQ), à Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ, proc. E-26/211.235/2021). L. F. L. O. agradece a Universidade Estadual do Norte Fluminense Darcy Ribeiro (UENF, bolsa IC-10) e L. F. R. à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa. M. T. G. também agradece ao CNPq pelo apoio financeiro (proc. 316335/2021-5 PQ).
REFERÊNCIAS 1. Yakimov, M. M.; Bargiela, R.; Golyshin, P. N.; Curr. Opin. Biotechnol. 2022, 73, 337. [Crossref] 2. Oliva, A. L.; La Colla, N. S.; Arias, A. H.; Blasina, G. E.; Lopez Cazorla, A.; Marcovecchio, J. E.; Environ. Sci. Pollut. Res. 2017, 24, 18979. [Crossref] 3. Ohiozebau, E.; Tendler, B.; Codling, G.; Kelly, E.; Giesy, J. P.; Jones, P. D.; Environ. Geochem. Health 2017, 39, 139. [Crossref] 4. Achten, C.; Andersson, J. T.; Polycyclic Aromat. Compd. 2015, 35, 177. [Crossref] 5. Sooraj, N. S.; Vineetha, V. P.; Sagar, S.; Tejaswi, H. N.; Pillai, D.; Regional Studies in Marine Science 2023, 68, 103254. [Crossref] 6. Ju, Y. R.; Chen, C. F.; Wang, M. H.; Chen, C. W.; Dong, C. D.; J. Hazard. Mater. 2022, 421, 126708. [Crossref] 7. Choueri, R. B.; Abessa, D. M. S.; de Carvalho, M. U.; Pazini, B.; Zanardi-Lamardo, E.; Rojas, L. A. V.; de Carvalho, P. S. M.; de Andrade, N. V. M.; de Souza Santos, L. P.; Ferraz, M. A.; Alves, A. V.; Castro, I. B.; Mar. Pollut. Bull. 2024, 200, 116063. [Crossref] 8. Wenzl, T.; Zelinkova, Z.; Food Chem. 2018, 1, 455. [Crossref] 9. Soares, M. O.; Rabelo, E. F.; Mar. Environ. Res. 2023, 187, 105936. [Crossref] 10. Pena, P. G. L.; Northcross, A. L.; de Lima, M. A. G.; Rêgo, R. C. F.; Cadernos de Saúde Pública 2020, 36, e00231019. [Crossref] 11. Magalhães, K. M.; Carreira, R. S.; Rosa Filho, J. S.; Rocha, P. P.; Santana, F. M.; Yogui, G. T.; Mar. Pollut. Bull. 2022, 175, 113334. [Crossref] 12. de Araújo, M. E.; Ramalho, C. W. N.; de Melo, P. W.; Cadernos de Saúde Pública 2020, 36, e00230319. [Crossref] 13. Soares, E. C.; Bispo, M. D.; Vasconcelos, V. C.; Soletti, J. I.; Carvalho, S. H. V.; de Oliveira, M. J.; dos Santos, M. C.; Freire, E. S.; Nogueira, A. S. P.; Cunha, F. A. S.; Sandes, R. D. D.; dos Santos, R. A. R.; Leite Neta, M. T. S.; Narain, N.; Garcia, C. A. B.; da Costa, S. S. L.; Santos, J. C. C.; Mar. Pollut. Bull. 2021, 171, 112723. [Crossref] 14. Agência Nacional de Vigilância Sanitária (ANVISA); Nota Técnica No. 27/2019, Riscos à Saúde Humana Decorrentes do Consumo de Pescados Oriundos das Praias Contaminadas por Óleo Cru na Região Nordeste do Brasil, 2019. [Link] acessado em Setembro 2024 15. United States Environmental Protection Agency (US EPA); Method 8265:Volatile Organic Compounds in Water, Soil, Soil Gas, and Air by Direct Sampling Ion Trap Mass Spectrometry; US EPA: Cincinnati, 2002. [Link] acessado em Setembro 2024 16. Prata, R.; López-Ruiz, R.; Nascimento, L. E. S.; Petrarca, M. H.; Godoy, H. T.; Frenich, A. G.; Arrebola, F. J.; J. Food Compos. Anal. 2024, 129, 106062. [Crossref] 17. da Silva, S. A.; De Rossi, G. Z.; Ossugui, M. M.; de Almeida, A. P.; Guizellini, G. M.; Sampaio, G. R.; da Silva Torres, E. A. F.; Food Analytical Methods 2023, 16, 293. [Crossref] 18. Dolatto, R. G.; Pont, G. D.; Vela, H. S.; Camargo, M. S.; Ostrensky Neto, A.; Grassi, M. T.; Anal. Sci. 2023, 39, 573. [Crossref] 19. Ahmed, I.; Jan, K.; Fatma, S.; Dawood, M. A. O.; J. Anim. Physiol. Anim. Nutr. 2022, 106, 690. [Crossref] 20. Araujo, D. F. S.; Silvestre, D. D.; Damasceno, K. S. F. S. C.; Pedrosa, L. F. C.; Seabra, L. M. A. J.; Cienc. Rural 2012, 42, 1130. [Crossref] 21. de Sá Júnior, P. L. S.; da Silva, L. J.; Andrade, H. A.; de Oliveira Filho, P. R. C.; Arq. Cienc. Mar. 2020, 53, 52. [Crossref] 22. Araújo, A. C. S.; da Rocha, M.; Prentice-Hernández, C.; 3a Semana Integrada UFPEL; Pelotas, Brasil, 2017. [Link] acessado em Setembro 2024 23. Balieiro, A. L.: Estudo sobre a Presença de Ácidos Graxos e de Histamina em Pescado Consumido no Estado de Sergipe; Dissertação de Mestrado, Universidade Federal de Sergipe, São Cristovão, Brasil, 2010. [Link] acessado em Setembro 2024 24. de Araújo, D. H. P.: Determinação de Histamina e Outras Aminas Bioativas e Perfil de Ácidos Graxos de Peixes da Região Amazônica; Dissertação de Mestrado, Universidade Federal do Pará, Belém, Brasil, 2013. [Link] acessado em Setembro 2024 25. Rodrigues, A. P. O. Em Piscicultura de Água Doce: Multiplicando Conhecimentos; Rodrigues, A. P. O.; Lima, A. F.; Alves, A. L.; Rosa, D. K.; Torati, L. S. T.; dos Santos, V. R. V., eds.; Embrapa: Brasília, 2013. 26. de Melo, A. P. Z.; Hoff, R. B.; Molognoni, L.; Kleemann, C. R.; de Oliveira, T.; de Oliveira, L. V. A.; Daguer, H.; Barreto, P. L. M.; Food Analytical Methods 2022, 15, 1826. [Crossref] 27. Martins, M. F.; Costa, P. G.; Bianchini, A.; Environ. Pollut. 2020, 265, 114923. [Crossref] 28. Martins, M. F.; Costa, P. G.; Bianchini, A.; Chemosphere 2021, 263, 128275. [Crossref] 29. Said, T. O.; Idris, A. M.; Sahlabji, T.; Polycyclic Aromat. Compd. 2020, 40, 758. [Crossref]
Editor Associado responsável pelo artigo: Boniek G. Vaz |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access