Artigo
|
|
| Aplicação da lama de beneficiamento de rochas ornamentais como catalisador no processo foto fenton para a descoloração de corante em solução aquoso Application of abrasive mud from the processing of ornamental rocks as a catalyst in the photo fenton process for the decolorization of dye in aqueous solution |
|
Mayra N. MouraI; Ana C. S. CamposI; Victor L. O. NevesI; Victória P. PoloniniI; Jenifer R. AlmeidaI; Luma B. MagnagoI; I. Departamento de Química, Centro de Ciências Exatas (DQUI/CCE), Universidade Federal do Espírito Santo, 29075-910 Vitória - ES, Brasil Recebido: 04/06/2024 *e-mail: mfflelis@yahoo.com.br The extraction and processing of ornamental rocks generate a very significant amount of waste, representing an environmental and public health problem. The residue is a fine-grained compound by rock powder and inputs used in the processing process have a potential economic value. The present study was carried out to evaluate the efficiency of the waste generated in the discoloration of an aqueous solution containing methylene blue dye, such as alternative for treating textile effluents. The samples were characterized by X-ray diffraction, inductively coupled plasma optical emission spectroscopy, scanning electron microscopy, transmission electron microscopy and energy dispersive X-ray spectroscopy. The catalytic properties of the samples were evaluated in the Fenton and photo Fenton reactions at pH 3 and natural pH. The best decolorization efficiency (≈ 95%) was achieved using the GRM catalyst at pH 3, after 5 min of photo Fenton reaction. Importantly, owing to its excellent structural and chemical stability, the samples showed a decolorization efficiency above 95% after 5 consecutive cycles of 30 min of reaction. This innovative strategy not only offers a new prospect for the rational disposal of abrasive mud waste, but also contributes to minimizing environmental impacts, promoting sustainable development in the stone industry. INTRODUÇÃO A destinação adequada dos rejeitos é um dos principais desafios enfrentados em todo o mundo. Motivado por questões sociais, econômicas, ambientais e culturais tem havido um incentivo global para a prática da reciclagem, uma solução promissora para mitigar o impacto ambiental causado pelo consumo de matérias primas e a geração de rejeito.1,2 Diminuir a formação de resíduos na fonte geradora e estudos sobre a sua reutilização são importantes para proporcionar benefícios ambientais e econômicos. As atividades relacionadas à extração e beneficiamento de rochas ornamentais promovem crescimento econômico no país, porém geram uma grande quantidade de resíduos que são, muitas vezes, destinados de forma inadequada.3 A utilização dos rejeitos como alternativa para o reaproveitamento é uma forma de proporcionar um desenvolvimento sustentável do setor, agregando valor a esses rejeitos, trazendo resultados positivos para a comunidade e para o meio ambiente. O Brasil é o quinto produtor e exportador mundial de rochas ornamentais e os estados do Espírito Santo, Minas Gerais, Ceará e Bahia registraram em 2022 um faturamento superior a US$ 10 milhões com as exportações. O Espírito Santo é responsável por aproximadamente 82,5% do total do faturamento, seguido por Minas Gerais com 10,7% do total brasileiro.4 Apesar do alto potencial econômico do setor de rochas ornamentais, estima-se que uma quantidade de 2 a 2,5 milhões de toneladas de rejeitos do setor são gerados por ano no Brasil.5,6 O beneficiamento de rochas ornamentais envolve a serragem dos blocos utilizando lâminas de teares com o auxílio de uma lama abrasiva composta de água, granalha de aço e calcário ou carbureto de cálcio. A lama abrasiva, após processo de serragem, é um rejeito de granulação fina composta por pó de rocha e pelos insumos usados no beneficiamento. Nesse contexto, o setor de rochas ornamentais enfrenta o desafio de descartar de forma adequada uma quantidade substancial de rejeitos ao longo do processo para evitar impactos ambientais, incluindo poluição do solo e da água e danos à vida aquática.3,7 Uma das dificuldades de aplicação da lama abrasiva se deve a sua composição heterogênea, proveniente das características intrínsecas das rochas extraídas e dos insumos utilizados em seu beneficiamento. Pesquisadores de diversas áreas do conhecimento têm buscado alternativas para inserir rejeitos no ciclo produtivo de novos materiais para que a economia do setor se torne cada vez mais sustentável e passe de linear para circular.8,9 Rejeitos de granito têm sido utilizados na produção de compósitos cerâmicos;10,11 concretos;12,13 argamassas;14 cimento2,15,16 e como pigmento inerte em tintas.17 Nos últimos anos vem crescendo o interesse pelo desenvolvimento de novas tecnologias capazes de remover contaminantes orgânicos presentes em efluentes industriais. A lama abrasiva proveniente da serragem de blocos de granitos (rochas silicatadas) e de mármores (rochas carbonáticas) do estado do Espírito Santo apresentam teor médio de SiO2 em torno de 60 e 11% de Fe2O3.18 A lama abrasiva é um rejeito que pode ser utilizado nos processos oxidativos avançadas (POA’s) como fonte de ferro em reações do tipo Fenton para a redução de poluentes orgânicos e da cor proveniente dos corantes presente nos efluentes têxteis. Os POA’s utilizam principalmente radicais hidroxila (•OH), espécie altamente oxidante.19-21 A reação de Fenton é um tipo de POA, geralmente descrito pela Equação 1,22,23 na qual íons Fe2+, na presença de peróxido de hidrogênio, geram radicais hidroxila (•OH). Os radicais hidroxila podem oxidar a grande maioria da matéria orgânica e degradá-la em produtos intermediários, que são eventualmente degradados em pequenas moléculas, como água e dióxido de carbono,24,25 sendo considerado um dos métodos de tratamento de água mais promissores. 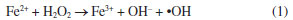 A reação de Fenton utilizando catalisadores homogêneos apresenta algumas desvantagens como a necessidade de ser realizada em condições ácidas e a produção de lodo como subproduto.26 A eficiência das reações de Fenton podem ser melhoradas utilizando catalisadores heterogêneos. Na presença de catalisadores heterogêneos, a faixa de pH na qual a reação de Fenton ocorre eficientemente é expandida, reduz a formação de complexos e hidróxidos de ferro, e o catalisador pode ser recuperado e reutilizado em novos ciclos catalíticos.27 A busca por catalisadores Fenton heterogêneos eficientes e de baixo custo tem despertado o interesse de muitos pesquisadores.28-36 Diferentemente do sistema Fenton, o processo foto Fenton utiliza uma combinação de luz solar ou radiação UV com a reação de Fenton, o que acelera a geração de radicais hidroxila. Essa junção tem o poder de produzir mais radicais hidroxila que o sistema Fenton convencional e aumentar a eficiência da degradação de poluentes orgânicos.24,31,37 As águas residuais das indústrias têxteis contendo diversos corantes e produtos químicos representam um desafio ambiental significativo. Entre os compostos químicos encontrados nessas águas residuais, estão os corantes que são tóxicos para o meio aquático, modificando a qualidade dos corpos d’água afetando a vida aquática.38,39 Os corantes podem causar toxicidade, mutagenicidade e carcinogenicidade, representando riscos para os ecossistemas e para as pessoas. A remoção de corantes no meio aquoso é um desafio devido à sua estrutura molecular complexa e de difícil degradação.40,41 Portanto, é necessário tratar adequadamente essas águas residuais para minimizar os impactos no meio ambiente. Este trabalho tem como objetivo investigar a aplicação da lama abrasiva proveniente do beneficiamento de mármore e granito como catalisador no processo oxidativo avançado do tipo Fenton e foto Fenton para a descoloração do corante azul de metileno em uma solução aquosa. A contribuição original e inovadora do trabalho é promover a industrialização inclusiva e sustentável por meio do uso consciente de recursos naturais, enquanto contribui com o desenvolvimento sustentável e a economia circular.
PARTE EXPERIMENTAL Preparo da amostra da lama abrasiva e separação das frações A amostra de lama abrasiva de mármore e granito foi fornecida pela indústria de rochas ornamentais de Castelo, no estado do Espírito Santo, Brasil, coletada segundo a norma ABNT NBR 10004:200442 para amostragem de resíduos sólidos. A remoção dos fragmentos maiores foi feita utilizando peneira de 2 mm de abertura - ASTM 10 Mesh/Tyler para obtenção de frações mais finas e uniformes (Figura 1). Em seguida, foi realizado o quarteamento,42 e a amostra denominada GRA foi armazenada adequadamente. A partir da amostra GRA foi realizada a separação magnética com o auxílio de um ímã sob agitação, separando a fração magnética, denominada GRM e a fração não magnética denominada GRR.

Caracterização das amostras GRA, GRM e GRR As amostras GRA, GRM e GRR foram caracterizadas por difratometria de raios-X usando um difratômetro D8 Discover (Bruker, EUA) com radiação CuKα (λ = 1,54056 Å) e velocidade de varredura de 1° min–1 numa faixa de 2θ 10-90° e a microscopia eletrônica de varredura (MEV) em microscópio eletrônico de varredura Superscan SSX-550 (Shimadzu, Japão) com AccV 25,0 kV e sonda 4,0. As análises de espectroscopia de raios-X de energia dispersiva (EDS) foram conduzidas usando um detector de energia (Bruker, XFlash® Detector 6|10, Billerica, EUA) acoplado ao MEV. A microscopia eletrônica de transmissão (MET) foi realizada em equipamento JEOL JEM 1400 (JEOL, Tóquio, Japão) com resolução de 120 kV e um filamento LaB6. A análise química da amostra foi realizada pelo método EPA 3050B.43 A amostra foi lixiviada em solução de HCl e HNO3 na proporção de 1:3 respectivamente, sob agitação constante a 80 °C por 2 h. Em seguida foi filtrada e a solução resultante analisada pela espectrometria de emissão ótica com plasma indutivamente acoplado (ICP OES) em um espectrômetro Optima 7000 Dual View (PerkinElmer Instruments, EUA), após diluições adequadas. Os reagentes químicos empregados neste estudo foram de grau analítico e as soluções foram preparadas com água deionizada. O teor de ferro foi determinado em cada amostra pelo método de titulação volumétrica com K2Cr2O7, segundo a ABNT NBR 8577:2011.44 Descoloração da solução do corante azul de metileno A solução do corante azul de metileno (AM) foi utilizada para avaliar a eficiência do tratamento proposto. O AM é um corante catiônico, composto por anéis aromáticos e de difícil degradação biológica. A lama abrasiva de mármore e granito foi avaliada como catalisador em três condições distintas: sem nenhum tratamento especial (GRA); após processo de separação magnética (GRM); e com a fração não magnética (GRR). Além do uso das amostras como adsorvente, vários experimentos foram realizados para determinar o desempenho dos catalisadores GRA, GRR e GRM na descoloração do corante AM em pH 3,0 e em pH natural, pelos processos Fenton e foto Fenton heterogêneo. Foi utilizada uma solução de AM na concentração 15,0 mg L–1 (Neon, Brazil). As soluções foram colocadas em contato com os catalisadores GRA, GRM e GRR e deixadas no escuro por 1 h para avaliar a capacidade de adsorção. O experimento foi realizado em um béquer de 100 mL, nas seguintes condições: (i) sistema I: apenas 50,0 mL de solução de AM; (ii) sistema II: 50,0 mL de solução de AM e 30,0 mg de catalisador; (iii) sistema III: 50,0 mL de solução de AM e 0,5 mL de H2O2 0,03 mol L–1 e (iv) sistema IV: 50,0 mL de solução de AM, 0,5 mL de H2O2 0,03 mol L–1 e 30,0 mg de catalisador. Foram preparadas duas seções de experimentos, uma em cabine escura e outra na presença da luz UV, em triplicata. Os processos Fenton (em uma cabine escura) e foto Fenton (na presença da luz UV) tiveram início com a adição de peróxido de hidrogênio, após o período de adsorção. O monitoramento da descoloração do AM foi feito no comprimento de onda característico de 665 nm em um espectrofotômetro UV/Visível modelo DR 5000 (HACH, USA), varredura variando de 200 a 900 nm, nos intervalos de tempo predeterminados (5, 15, 30, 60 min em pH 3,0 e 15, 30, 45, 60, 90, 120 e 150 min em pH natural).
RESULTADOS E DISCUSSÃO Caracterização das amostras GRA, GRR e GRM Os difratogramas de raio X (DRX) das amostras de lama abrasiva são apresentados nas Figuras 2a (GRA), 2b (GRM) e 2c (GRR). Os difratogramas foram interpretados com os softwares APD (Automated Powder Diffraction) da PHILIPS e com as fichas PDF (Powder Diffraction File) do ICDD (International Center for Diffraction Data). De acordo com os padrões de DRX, na amostra GRA verificam-se picos de difração característicos da fase cristalina referentes ao quartzo (SiO2). Também picos característicos da granalha de aço (α-Fe), magnetita (Fe3O4), albita (Na(AlSi3O8)), mica (muscovita [KAl2(Si3AlO10) (OH,F2)]), calcita (CaCO3) e, em pequenas quantidades, a presença de dolomita (CaMg(CO3)2. Estes resultados confirmam a presença dos constituintes principais das rochas ornamentais, que são ricas em feldspatos e quartzo.
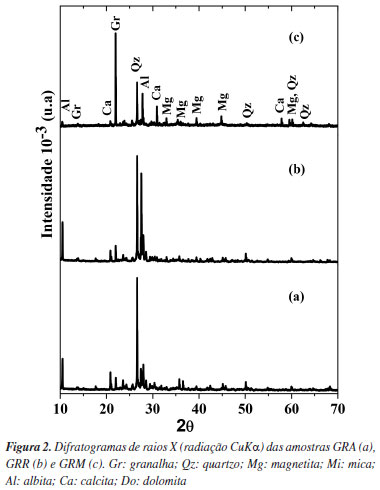
Os picos do difratograma de raios X da amostra GRM comprova a presença predominante de α-Fe no concentrado magnético, procedente da granalha de aço utilizada no processo de corte/serragem dos blocos de granito e mármore. Observa-se também a existência de picos de baixa intensidade referente a magnetita, que junto ao α-Fe são responsáveis pelo caráter magnético da amostra. A amostra GRR apresenta picos característicos de quartzo, albita e mica. Mesmo sendo uma análise qualitativa, as intensidades dos picos nos difratogramas refletem a eficiência da separação magnética. A falta de picos característicos de óxidos de ferro na amostra GRR, pode estar relacionada ao baixo teor de ferro (2,81%), uma vez que a identificação mineral em padrões de DRX só é possível para teores superiores a 3-5% em massa.31 O teor de ferro, lixiviado em solução ácida de HCl e HNO3, nas amostras GRA e GRM foi de 7,68 e 58,64% em peso, respectivamente. As imagens de MEV (Figura 3) mostram as micrografias das amostras de GRA (Figuras 3a e 3b), GRM (Figuras 3c e 3d) e GRR (Figuras 3e e 3f), respectivamente, em ampliações de 2.500 e 10.000 vezes. Observou-se que os grãos minerais da lama abrasiva e suas respectivas frações não possuem uma forma definida, apresentando partículas com geometria irregular.

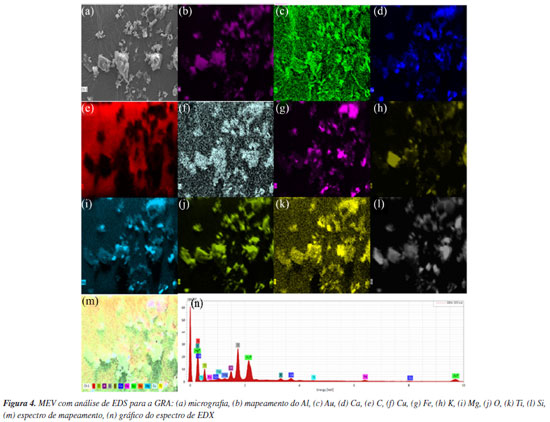
As análises de EDS acoplado ao MEV, foram realizadas apenas na amostra GRA e são apresentadas na Figura 4. Por meio do mapeamento por EDS observou-se que o material é constituído basicamente de Al, Ca, C, Cu, Fe, K, Mg, O, Ti e Si (Figura 4n). Esta análise confirmou a presença dos principais constituintes das rochas ornamentais (ricas em feldspatos e quartzo) e granalha de ferro utilizada no processo de serragem dos blocos de rocha, coerente com as análises de DRX (Figura 2).
A Figura 5 mostra as análises realizadas por MET das amostras GRA (a), GRM (b) e GRR (c), demonstrando que as partículas se encontram em escala nanométrica (menores que 50 nm), com a presença de aglomerados formados por microporos. Esses resultados estão de acordo com as análises de MEV (Figura 3).
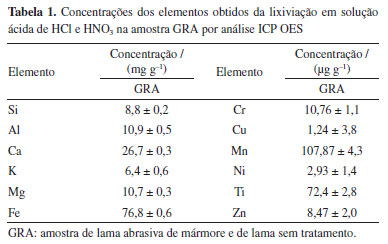
Na Tabela 1 é apresentada a análise química por ICP OES, realizada apenas na amostra GRA, após a lixiviação em solução ácida. As maiores concentrações encontradas foram de Si, Fe, Al, Ca, K e Mg, corroborando com os resultados de EDS e DRX. Os altos teores de Si, Al, K e Mg estão relacionados a rocha graníticas constituídas principalmente de quartzo, mica e feldspatos potássico (KAlSi3O4) e feldspatos sódico (NaAlSi3O4). As altas concentrações de Fe e Ca estão relacionadas, principalmente, aos constituintes do próprio resíduo, como a adição de granalha de aço e CaO no processo de corte/serragem do granito. Os elementos Cr, Cu, Mn, Ni, Ti e Zn são encontrados em menores concentrações, provenientes de alguns minerais da rocha (como mica e biotita).
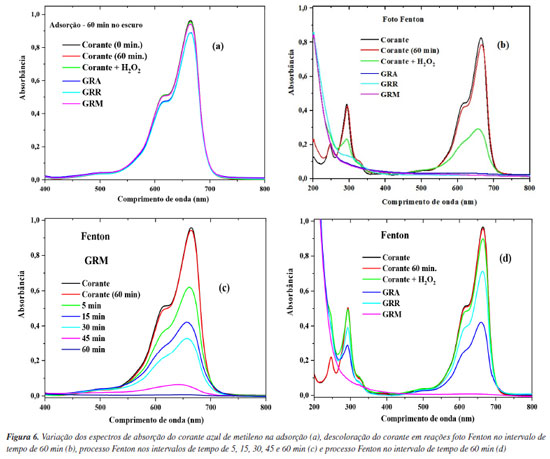
Aplicação de GRA, GRR e GRM como catalisadores na descoloração do corante AM As soluções de AM foram deixadas em contato com o catalisador por 60 min, no escuro, para avaliar o processo de adsorção. Após este período, ocorreu a adição do peróxido de hidrogênio e iniciou-se o processo Fenton e foto Fenton heterogêneo. A eficiência de descoloração da solução de AM, utilizando os catalisadores GRA, GRR e o GRM foram monitoradas nos intervalos de tempo de 5, 15, 45 e 60 min. A Figura 6 mostra a variação dos espectros de absorção do corante AM em várias condições de descoloração usando os catalisadores, indicando que o pico dos espectros de absorção diminui à medida que o tempo de descoloração aumenta.
Nos experimentos de adsorção (Figura 6a) uma redução no pico correspondente ao comprimento de onda de 665 nm, indica uma pequena remoção do corante. O uso das amostras GRA, GRR e GRM como adsorvente na solução do corante AM (pH = 3,0) não apresentou eficiência significativa no pH estudado. Os valores de adsorção foram de 8,5% (GRA), 8,9% (GRR) e 2,4% (GRM) no intervalo de 60 min (Figura 6a). Para o uso do material como possível adsorvente eficaz para aplicação na área ambiental, será necessário avaliar o aumento da capacidade de adsorção, com a variação do pH e/ou modificações da superfície do adsorvente. Na Figura 6b (foto Fenton), observa-se o desaparecimento do pico característico no comprimento de onda de 665 nm com os catalisadores GRA, GRR e GRM, após 60 min de reação. Na Figura 6d (Fenton) verifica-se que GRM se destaca muito quando comparada a GRA e GRR, conforme intensidade do pico em 665 nm. O desaparecimento do pico no comprimento de onda entre 280 e 350 nm indica que o AM foi quase completamente degradado. A eficiência de adsorção e descoloração (Edesc) foi calculada pela redução da concentração do corante, evidenciada por uma redução na absorção a 665 nm (Figura 7) referente ao comprimento de onda de máxima absorção do corante AM, conforme a Equação 2. 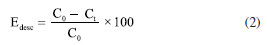
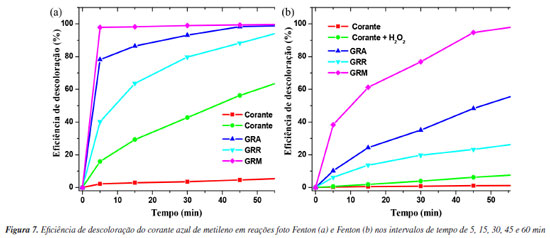
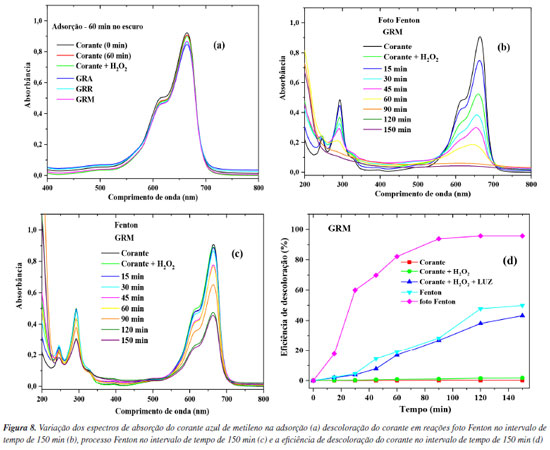
onde C0 (mg L–1) é a concentração inicial e Ct (mg L–1) a concentração no tempo t da solução de AM. Os processos oxidativos avançados podem ser uma metodologia prospectiva para a eliminação de compostos orgânicos em meio aquoso. Comparando os processos foto Fenton (Figura 6b) e o Fenton (Figuras 6c e 6d), observa-se que no sistema IV com a utilização do catalisador GRM, a eficiência de descoloração do corante atingiu 98% (Figura 7a) após 5 min de reação. Os catalisadores GRA e GRR (Figura 7a), apresentaram o mesmo nível de eficiência somente depois de 60 min de reação, provavelmente devido a uma menor concentração de ferro e granalha (α-Fe) presente na amostra. No processo Fenton, a eficiência de descoloração do corante foi de 38,2% (Figura 7b) para a amostra GRM, após 5 min de reação. Utilizando os catalisadores GRA, GRR e GRM a eficiência de descoloração foi de 58,6, 27,2 e 99,2%, respectivamente, após 60 min de reação. Para verificar a presença do ferro residual, ao final da reação, foi realizada a análise por ICP OES (espectrômetro de emissão atômica com plasma indutivamente acoplado). O maior valor encontrado de ferro total dissolvido na solução final foi de 0,35 ± 0,03 mg L–1, demonstrando haver a presença da reação tipo Fenton homogênea clássica. A presença de ferro dissolvido só foi detectada no final da reação, no qual boa parte da cor já havia sido degradada. Estes resultados revelam que a reação de Fenton na fase homogênea é importante, no entanto, deve-se considerar que a reação de Fenton heterogênea apresentou uma maior descoloração no início da reação, aumentando consideravelmente a remoção da cor do corante estudado. O uso das amostras GRA, GRR e GRM como adsorvente em pH natural não apresentou eficiência significativa (Figura 8a), por conseguinte, não houve a descoloração da solução de AM na solução testada. No processo foto Fenton e Fenton em pH natural observa-se a redução no pico correspondente ao comprimento de onda de 665 nm (Figuras 8b e 8c), indicando uma eficiência de descoloração acima de 95% pelo processo foto Fenton e 50% no processo Fenton, após 120 min de reação, utilizando o catalisador GRM (Figura 8d). Na utilização dos catalisadores GRA e GRR no processo Fenton e foto Fenton em pH neutro, apesar de ocorrer redução dos picos no espectro de adsorção, não foi suficiente para observar visualmente. No entanto, observa-se a dispersão de pequenas partículas, provocando a turvação, possivelmente advindas do resíduo de lama abrasiva. As partículas em suspensão oriunda do resíduo, provoca um aumento de intensidade no comprimento de onda variando de 200 a 800 nm.
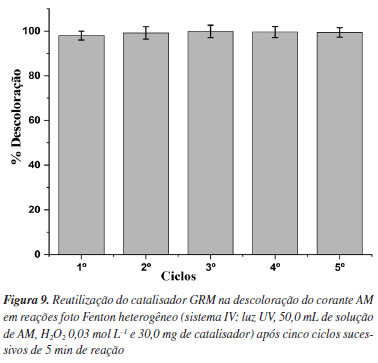
Segundo Janssens et al.,45 o método foto Fenton quando comparado ao Fenton, possui as vantagens da taxa de redução de Fe2+ ser melhorada devido a presença da luz, bem como a melhoria da utilização de H2O2. A introdução de luz ultravioleta no processo Fenton pode acelerar a taxa de regeneração de Fe2+, apresentando um efeito sinérgico da luz ultravioleta e Fe2+ sobre a decomposição de H2O2.46 As espécies oxidantes ativas como HO• são produzidas em um intervalo de tempo muito curto em comparação com as reações de Fenton, resultando em rápida oxidação de contaminantes. Observa-se o principal efeito do ferro sobre a cinética do processo, em que a presença do α-Fe na amostra do catalisador potencializa a reação Fenton, gerando mais radicais HO•.31 O sistema I (somente corante) na presença de luz ultravioleta, apresentou uma descoloração de apenas 5,8%. O sistema III (corante + H2O2) apresentou uma eficiência de descoloração de 67,0%, na presença da luz UV e na ausência de íons de ferro. Na presença de luz ultravioleta, sem a presença do ferro, pode ocorrer uma taxa de conversão de H2O2 para HO•, promovendo a oxidação do composto orgânico.24-36 Os resultados obtidos no presente trabalho com a metodologia proposta foram bastantes promissores. A eficiência de descoloração de corantes em reações Fenton heterogêneo e foto Fenton heterogêneo foi estudada por Biazati et al.36 que investigaram a degradação do corante índigo carmim, utilizando a ferrita de zinco (ZnxFe(3–x)O4) como catalisador e obtiveram uma eficiência de descoloração do corante de 40% na reação sem a presença de luz e de 98% na reação com presença de luz após 100 min. Ramos et al.24 também estudaram a degradação do corante índigo carmim e concluíram que o processo foto Fenton heterogêneo foi mais eficiente do que o processo Fenton heterogêneo. Moura et al.,35 usando a ferrita de cobalto a partir de bateria de íon-Li (CoFe2O4-LIBs) como catalisador, obtiveram 87,7% de descoloração do corante após 420 min. Morais et al.,30 usando a ferrita de manganês a partir da bateria Zn-MnO2 (MnFe2O4(B)), tiveram resultado de 92% de descoloração do corante após 120 min de reação. Eficiência de 96% de descoloração do corante após 45 min de reação foi alcançada com a ferrita de cobre obtida a partir da bateria íon-Li (CuFe2O4-LIB).34 Quando utilizada a ferrita de níquel sintetizada a partir da bateria Ni-MH (NiFe2O4 (Ni-MH)) o resultado obtido foi de 99% de eficiência de descoloração em 180 min de reação.33 A vantagem do uso da lama abrasiva como catalisador em relação as ferritas sintetizadas, dispensa muitos processos químicos necessários na preparação da ferrita. Ao final da reação de descoloração do corante, o catalisador GRM foi facilmente retirado da solução por um ímã e a estabilidade foi avaliada por meio de reciclagem e uso em ciclos de reações foto Fenton. É importante ressaltar que a reutilização do catalisador em vários ciclos de reação indica eficiência e menor custo do processo. Nas condições estudadas, não foi observada perda significativa de atividade catalítica após cinco ciclos consecutivos de 30 min de reação. (Figura 9), alcançando eficiência de descoloração do corante de 98,0; 99,2; 99,9; 99,6 e 99,4% após o 1º, 2º, 3º, 4º e 5º ciclos, respectivamente. Após cada reação, o catalisador foi retirado da solução com o auxílio de um imã. Após o primeiro ciclo de reação, verificou-se que a eficiência de descoloração do corante AM aumentou significativamente até o terceiro ciclo, provavelmente com a remoção de material depositado na superfície da amostra, não removido totalmente por separação magnética. Os resultados obtidos indicam que GRM apresentou boa estabilidade no meio reacional, sem perda significativa de eficiência catalítica, indicando uma alta capacidade de reaproveitamento em mais ciclos de reação de descoloração do corante.
Gebreslassie et al.47 investigaram a estabilidade do fotocatalisador produzido (CoFe2O4-loaded g-C3N4) para degradação do corante azul de metileno, demonstrando que a fotoatividade não mudou significativamente após cinco ciclos consecutivos. Singh et al.48 sintetizaram monólitos de Fe2O3/TiO2 e avaliou a degradação do corante vermelho brilhante (RbX) e do inseticida fipronil. Observaram que o catalisador foi reciclado com sucesso por quatro ciclos apresentando excelente eficiência e estabilidade na reutilização. O mecanismo para degradação da molécula do azul de metileno foi estudado por Wen et al.49 obtendo ao final do processo íons inorgânicos (NO3–, SO42– e NH4+) e ácido metanóico. Moura et al.35 ainda encontraram outros ácidos orgânicos menos poluentes (ácido acético e ácido propiônico). Nos espectros de absorção UV-Vis das soluções de descoloração do azul de metileno (Figuras 6b e 6d) não foram observadas bandas entre 300 a 400 nm, após 60 min de reação, indicando a degradação completa de intermediários. Bandas de absorção abaixo de 230 nm representa o peróxido de hidrogênio residual.50
CONCLUSÃO No presente estudo foi possível concluir que o resíduo possui alto potencial para atuar como material catalítico em processos oxidativos avançados do tipo Fenton. Foi investigada a descoloração do corante azul de metileno (AM) em solução aquosa utilizando a lama abrasiva da empresa de mármore e granito em Castelo/ES como catalisador pelo processo Fenton e foto Fenton. Os resultados mostraram que a descoloração do corante AM em solução aquosa pelo processo foto Fenton é mais rápida que os processos Fenton e UV/H2O2. Isto pode ser explicado pelas hidroxilas adicionais produzidas pela decomposição catalítica e fotodecomposição do H2O2. Entre as 3 amostras estudadas (GRA, GRR e GRM), a GRM apresentou eficiência de 98% de descoloração de AM após 5 min de reação foto Fenton em pH 3. As amostras GRA e GRR apresentaram uma descoloração do corante AM de 87 e 64%, respectivamente, após 15 min de reação foto Fenton. Após 60 min de reação foto Fenton, as 3 amostras apresentaram uma descoloração do corante AM acima de 99%. A reação Fenton heterogêneo, na ausência de radiação UV, apresentou uma porcentagem de descoloração do corante AM de 99% para GRM, 58% para GRA e 27% para GRR, após 60 min de reação. A amostra de GRM apresentou boa estabilidade, após 5 ciclos de reações sucessivas, com eficiência de descoloração do corante de 99,2, 99,9, 99,6 e 99,4% em 60 min de reação, nos 2º, 3º, 4º e 5º ciclos, respectivamente. O processo foto Fenton e Fenton em pH natural mostrou uma eficiência de descoloração acima de 95 e 50%, respectivamente, após 120 min de reação, utilizando o catalisador GRM. Concluímos que o estudo oferece possíveis aplicações para o resíduo gerado pelas indústrias de rochas ornamentais, como catalisador no processo Fenton, com a capacidade de degradar corantes presentes em efluentes da indústria têxtil, implementado uma prática para garantir a sustentabilidade ambiental e a minimização da descarga de rejeitos. Vale a pena ressaltar que o presente trabalho pode estimular novos estudos e incentivar a aplicação do processo com o uso da radiação solar, tornando-o mais sustentável.
AGRADECIMENTOS Os autores agradecem ao NCQP, UFES, CAPES, FAPES, Laboratório Multiusuário de Instrumentação - LabMInst (LabPetro-UFES, Brasil) pelas análises de FTIR (Acordo de Cooperação Técnica No. 1050.0022844.06.4), DRX (Acordo de Cooperação Técnica No. CT-Infra 01/2007-FINEP 0202/08), ICP OES, e Laboratório de Ultraestrutura Celular Carlos Alberto Redins (LUCCAR) pelas análises de MEV, EDS e MET.
REFERÊNCIAS 1. Nayak, S. K.; Satapathy, A.; Mantry, S.; Journal of Building Engineering 2022, 46, 103742. [Crossref] 2. Scolaro, T. P.; Silvestro, L.; Ruviaro, A. S.; de Azevedo, A. R. G.; Monteiro, S. N.; Pelisser, F.; Materials 2022, 15, 401. [Crossref] 3. Sarici, D. E.; Ozdemir, E.; J. Cleaner Prod. 2018, 201, 516. [Crossref] 4. Associação Brasileira da Indústria de Rochas Ornamentais (ABIROCHAS), Balanço do Setor Brasileiro de Rochas Ornamentais e de Revestimento em 2023 - Informe 01/2024, https://abirochas.com.br/wp-content/uploads/2024/03/Informe-01_2024-Balanco-2023.pdf, acessado em Outubro 2024. 5. Zulcão, R.; Calmon, J. L.; Rebello, T. A.; Vieira, D. R.; Constr. Build. Mater. 2020, 257, 119523. [Crossref] 6. Marques, F. C.; Silva, J. C. M.; Libardi, C. P.; de Carvalho, R. R.; Sequine, G. F.; Valane, G. M.; Renewable Energy 2020, 152, 1266. [Crossref] 7. Aguiar, L. L.; Tonon, C. B.; Nunes, E. T.; Braga, A. C. A.; Neves, M. A.; David, J. A. O.; Ecotoxicol. Environ. Saf. 2016, 125, 116. [Crossref] 8. Sillanpää, M.; Ncibi, M. C.; The Circular Economy: Case Studies about the Transition from the Linear Economy; Academic Press: Cambridge, MA, USA, 2019. 9. Vidal, F. W. H.; Azevedo, H. C. A.; Castro, N. F.; Tecnologia de Rochas Ornamentais: Pesquisa, Lavra e Beneficiamento; Centro de Tecnologia Mineral, CETEM/MCTI: Rio de Janeiro, Brasil, 2013. [Link] acessado em Outubro 2024 10. Xavier, G. C.; de Azevedo, A. R. G.; Alexandre, J.; Monteiro, S. N.; Pedroti, L. G.; J. Mater. Civ. Eng. 2019, 31, 04018381. [Crossref] 11. Acchar, W.; Avelino, K. A.; Segadães, A. M.; Adv. Appl. Ceram. 2016, 115, 236. [Crossref] 12. Ghorbani, S.; Taji, I.; Tavakkolizadeh, M.; Davodi, A.; de Brito, J.; Constr. Build. Mater. 2018, 185, 110. [Crossref] 13. Sharma, N. K.; Kumar, P.; Kumar, S.; Thomas, B. S.; Gupta, R. C.; Constr. Build. Mater. 2017, 151, 158. [Crossref] 14. de Azevedo, A. R. G.; Marvila, M. T.; Barroso, L. S.; Zanelato, E. B.; Alexandre, J.; Xavier, G. C.; Monteiro, S. N.; Materials 2019, 12, 1449. [Crossref] 15. Medina, G.; Sáez del Bosque, I. F.; Frías, M.; Sánchez de Rojas, M. I.; Medina, C.; J. Cleaner Prod. 2017, 148, 467. [Crossref] 16. Rana, A.; Kalla, P.; Csetenyi, L. J.; J. Cleaner Prod. 2015, 94, 304. [Crossref] 17. Lopes, M. M. S.; Pedroti, L. G.; de Oliveira, A. F.; Ribeiro, J. C. L.; de Carvalho, J. M. F.; de Carvalho, A. F.; Cardoso, F. P.; Nalon, G. H.; de Lima, G. E. S.; J. Cleaner Prod. 2021, 326, 129418. [Crossref] 18. Neves, N. A.; Prado, A. C. A.; Marques, R. A.; da Fonseca, A. B.; Machado, M. E. S.; Geociências 2021, 40, 123. [Crossref] 19. Jiang, T.; Wang, K.; Guo, T.; Wu, X.; Zhang, G.; Chin. J. Catal. 2020, 41, 161. [Crossref] 20. Qian, H.; Hou, Q.; Yu, G.; Nie, Y.; Bai, C.; Bai, X.; Ju, M.; J. Cleaner Prod. 2020, 273, 123028. [Crossref] 21. Kim, J.; Zhang, T.; Liu, W.; Du, P.; Dobson, J. T.; Huang, C.-H.; Environ. Sci. Technol. 2019, 53, 13312. [Crossref] 22. Cheng, M.; Zeng, G.; Huang, D.; Lai, C.; Xu, P.; Zhang, C.; Liu, Y.; Chem. Eng. J. 2016, 284, 582. [Crossref] 23. Zhu, R.; Cai, M.; Fu, T.; Yin, D.; Peng, H.; Liao, S.; Du, Y.; Kong, J.; Ni, J.; Yin, X.; Pharmaceutics 2023, 15, 1599. [Crossref] 24. Ramos, R. O.; Albuquerque, M. V. C.; Lopes, W. S.; Sousa, J. T.; Leite, V. D.; Journal of Water Process Engineering 2020, 37, 101535. [Crossref] 25. Khan, I.; Saeed, K.; Ali, N.; Khan, I.; Zhang, B.; Sadiq, M.; J. Environ. Chem. Eng. 2020, 8, 104364. [Crossref] 26. Ribeiro, J. P.; Nunes, M. I.; Environ. Res. 2021, 197, 110957. [Crossref] 27. Scaria, J.; Gopinath, A.; Nidheesh, P. V.; J. Cleaner Prod. 2021, 278, 124014. [Crossref] 28. Peramune, D.; Manatunga, D. C.; Dassanayake, R. S.; Premalal, V.; Liyanage, R. N.; Gunathilake, C.; Abidi, N.; Environ. Res. 2022, 215, 114242. [Crossref] 29. Soufi, A.; Hajjaoui, H.; Elmoubarki, R.; Abdennouri, M.; Qourzal, S.; Barka, N.; Applied Surface Science Advances 2021, 6, 100145. [Crossref] 30. Morais, V. S.; Barrada, R. V.; Moura, M. N.; Almeida, J. R.; Moreira, T. F. M.; Gonçalves, G. R.; Ferreira, S. A. D.; Lelis, M. F. F.; Freitas, M. B. J. G.; J. Environ. Chem. Eng. 2020, 8, 103716. [Crossref] 31. Ferreira, S. A. D.; Donadia, J. F.; Gonçalves, G. R.; Teixeira, A. L.; Freitas, M. B. J. G.; Fernandes, A. A. R.; Lelis, M. F. F.; J. Environ. Chem. Eng. 2019, 7, 103144. [Crossref] 32. Zhu, Y.; Zhu, R.; Xi, Y.; Zhu, J.; Zhu, G.; He, H.; Appl. Catal., B 2019, 255, 117739. [Crossref] 33. Magnago, L. B.; Rocha, A. K. S.; Pegoretti, V. C. B.; Ferreira, S. A. D.; Lelis, M. F. F.; Freitas, M. B. J. G.; Ionics 2019, 25, 2361. [Crossref] 34. Rocha, A. K. S.; Magnago, L. B.; Santos, J. J.; Leal, V. M.; Marins, A. A. L.; Pegoretti, V. C. B.; Ferreira, S. A. D.; Lelis, M. F. F.; Freitas, M. B. J. G.; Mater. Res. Bull. 2019, 113, 231. [Crossref] 35. Moura, M. N.; Barrada, R. V.; Almeida, J. R.; Moreira, T. R. F.; Schettino, M. A.; Freitas, J. C. C.; Ferreira, S. A. D.; Lelis, M. F. F.; Freitas, M. B. J. G.; Chemosphere 2017, 182, 339. [Crossref] 36. Biazati, L. B.; Lorenzini, L.; Ferreira, S. A. D.; Porto, A. O.; de Castro, E. V. R.; Fabris, J. D.; de Freitas, M. B. J. G.; Lelis, M. F. F.; J. Braz. Chem. Soc. 2022, 33, 135. [Crossref] 37. Liu, X.; Zhou, Y.; Zhang, J.; Luo, L.; Yang, Y.; Huang, H.; Peng, H.; Tang, L.; Mu, Y.; Chem. Eng. J. 2018, 347, 379. [Crossref] 38. Ali, S. S.; Al-Tohamy, R.; Sun, J.; Sci. Total Environ. 2022, 806, 150665. [Crossref] 39. Almroth, B. C.; Cartine, J.; Jönander, C.; Karlsson, M.; Langlois, J.; Lindström, M.; Lundin, J.; Melander, N.; Pesqueda, A.; Rahmqvist, I.; Renaux, J.; Roos, J.; Spilsbury, F.; Svalin, J.; Vestlund, H.; Zhao, L.; Asker, N.; Ašmonaitė, G.; Birgersson, L.; Boloori, T.; Book, F.; Lammel, T.; Sturve, J.; Ecotoxicol. Environ. Saf. 2021, 207, 111523. [Crossref] 40. Islam, T.; Repon, M. R.; Islam, T.; Sarwar, Z.; Rahman, M. M.; Environ. Sci. Pollut. Res. 2023, 30, 9207. [Crossref] 41. Al-Tohamy, R.; Ali, S. S.; Li, F.; Okasha, K. M.; Mahmoud, Y. A. G.; Elsamayh, T.; Jiao, H.; Fu, Y.; Sun, J.; Ecotoxicol. Environ. Saf. 2022, 231, 113160. [Crossref] 42. ABNT NBR 10004: Resíduos Sólidos - Classificação, Associação Brasileira de Normas Técnicas (ABNT): Brasil, 2004; https://www.normas.com.br/visualizar/abnt-nbr-nm/170/abnt-nbr10004-residuos-solidos-classificacao, acessado em Outubro 2024. 43. Kimbrough, D. E.; Wakakuwa, J. R.; Environ. Sci. Technol. 1989, 23, 898. [Crossref] 44. ABNT NBR 8577: Minérios de Ferro - Determinação do Teor de Ferro Total por Dicromatometria, Associação Brasileira de Normas Técnicas (ABNT): São Paulo, 2011, https://www.normas.com.br/visualizar/abnt-nbr-nm/3464/abnt-nbr8577-minerios-de-ferro-determinacao-do-teor-de-ferro-total-por-dicromatometria, acessado em Outubro 2024. 45. Janssens, R.; Cristovao, M. B.; Bronze, M. R.; Crespo, J. G.; Pereira, V. J.; Luis, P.; J. Environ. Chem. Eng. 2019, 7, 103351. [Crossref] 46. Ma, D.; Yi, H.; Lai, C.; Liu, X.; Huo, X.; An, Z.; Li, L.; Fu, Y.; Li, B.; Zhang, M.; Qin, L.; Liu, S.; Yang, L.; Chemosphere 2021, 275, 130104. [Crossref] 47. Gebreslassie, G.; Gebrezgiabher, M.; Lin, B.; Thomas, M.; Linert, W.; Inorganics 2023, 11, 119. [Crossref] 48. Singh, J.; Sharma, S.; Aanchal; Basu, S.; J. Photochem. Photobiol., A 2019, 376, 32. [Crossref] 49. Wen, C.; Zhu, Y.-J.; Kanbara, T.; Zhu, H.-Z.; Xiao, C.-F.; Desalination 2009, 249, 621. [Crossref] 50. Terres, J.; Battisti, R.; Andreaus, J.; de Jesus P. C.; Biocatal. Biotransform. 2014, 32, 64. [Crossref]
Associate Editor handled this article: Lucia Mascaro |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access