Artigo
|
|
| Determinação por espectrometria de massas do potencial de bioacumulação de contaminantes emergentes em biofilme Determination by mass spectrometry of the bioaccumulation potential of emerging contaminants in biofilm |
|
Luana Mayumi Takahasi MarquesI,* I. Departamento de Química e Biologia, Universidade Tecnológica Federal do Paraná, 81280-340 Curitiba - PR, Brasil Recebido: 01/04/2024 *e-mail: luanam@alunos.utfpr.edu.br Personal hygiene products, such as UV filters, are consumed daily and released at sewage treatment plants. The presence of these compounds in aquatic environments may cause concern, as their impacts are not yet fully known. Biofilms can be an innovative and simple tool for monitoring the bioaccumulation of contaminants such as UV filters in aquatic environments. The present work aimed to determine and evaluate the potential of bioaccumulation of these compounds in biofilm and in the surface waters of the Barigui River. The determination of contaminants in environmental matrices was performed by liquid chromatography coupled to triple-quadrupole mass spectrometry (LC-MS/MS). The validation of the methodology used was based on the acceptance criteria of the National Institute of Metrology, Quality and Technology (Inmetro). The results obtained in the samples ranged from the maximums of 5.85 μg L-1 of benzophenone-1 for water samples to 1907.40 μg kg-1 of benzophenone-3 for biofilm. The study showed that biofilm is a very useful new tool in environmental monitoring, mainly due to the bioaccumulation capacity of UV filters. INTRODUÇÃO Contaminantes emergentes são substâncias presentes no meio ambiente ainda sem legislação que foram recentemente detectadas ou identificadas como poluentes.1 Sua principal fonte no meio ambiente são os efluentes, atingindo facilmente o solo e a água.2 Esta classe traz preocupação crescente devido ao alto consumo humano.3 Os efluentes sanitários podem ser uma fonte potencial para entrada destes novos contaminantes nos ambientes aquáticos. Já foram registradas a presença em diferentes ecossistemas aquáticos, tais como águas superficiais, subterrâneas, sedimentos, solos e até mesmo em organismos aquáticos.4,5 Diariamente produtos de cuidados pessoais consumidos pela sociedade fazem parte de efluentes sanitários, sendo levados até os sistemas de tratamento de esgotos. Os efluentes sanitários podem contribuir para o incremento de contaminantes emergentes nos ambientes aquáticos, requerendo tratamentos avançados para sua remoção.6 Muitas destas substâncias são tóxicas ou classificadas como desreguladores endócrinos e a sua presença no ambiente pode afetar o equilíbrio ecológico.7,8 Outra preocupação é a capacidade de bioacumulação de alguns contaminantes e possível ampliação trófica dentro da cadeia alimentar.9 Os filtros ultravioletas (UV) são contaminantes emergentes preocupantes quando presentes nos ambientes aquáticos.10 Mesmo em baixas concentrações os filtros UV podem trazer preocupação à biota sobretudo pelo potencial de desregulação endócrina.11 A presença dos disruptores endócrinos nos ambientes aquáticos não pode ser negligenciada. Muitos destes compostos não são suficientemente removidos nas estações de tratamento de águas.12 Neste trabalho foram estudados a benzofenona-1, benzofenona-3, octocrileno e metoxicinamato octila. Em geral, esses tipos de compostos foram relatados como fotoestáveis e altamente lipofílicos, portanto, tendem a bioacumular no ambiente, em humanos e na fauna.13 Isto gera preocupação, que é agravada pela liberação direta desses compostos no meio ambiente. A espectrometria de massas acoplada a cromatografia líquida (LC-MS/MS) tem se tornado uma ferramenta importante no monitoramento ambiental devido a diversas vantagens como ampla aplicabilidade, velocidade, sensibilidade e exatidão.14 Nos ecossistemas aquáticos, a preocupação com a bioacumulação começa com os biofilmes, que estão na base da cadeia alimentar. Os biofilmes são um conjunto de células microbianas, formando uma comunidade complexa de bactérias, algas, fungos e outros microrganismos.15 Eles podem ser encontrados presos a muitas superfícies subaquáticas, como pedras, galhos de árvores, folhas e outros. Portanto, eles estão continuamente expostos ao fluxo dinâmico da água, nutrientes associados, outros microrganismos e poluentes. Os biofilmes são capazes de reter e acumular substâncias, incluindo nutrientes e poluentes, concentrando compostos na matriz ou incorporando na biomassa microbiana, via sorção e difusão.16-19 Além disso, o biofilme cresce rapidamente, é fácil de coletar e pode ser encontrado em quase todos os ambientes.20 Portanto, o biofilme, juntamente com outras análises, pode ser uma nova matriz biológica adequada para monitoramento e avaliação de contaminantes.21,22 Ao associar biofilme com amostradores, é possível utilizar o biofilme para biomonitoramento passivo para avaliação de várias classes de compostos de relevância.23,24 Os objetivos desta pesquisa foram: desenvolver uma metodologia para analisar filtros UV em água e biofilme, analisar contaminantes emergentes em biofilme coletado em um rio urbano subtropical localizado no sul do Brasil, comparar as concentrações detectadas em amostras de água e biofilme coletado com um amostrador construído para esse fim.
PARTE EXPERIMENTAL Reagentes e materiais Foram utilizados padrões de alta pureza de benzofenona-1 (BP-1 ≥ 99%), benzofenona-3 (BP-3 ≥ 98%), octocrileno (OC ≥ 98%) e metoxicinamato de octila (OMC ≥ 98%), todos adquiridos de Sigma-Aldrich (Steimheim, Alemanha). Os solventes utilizados nas análises cromatográficas (acetona, acetonitrila, metanol, etil acetato e hexano) de grau HPLC, e o ácido fórmico (LiChropur™, 85%) grau HPLC-MS, também foram adquiridos da Sigma-Aldrich (Steimheim, Alemanha). Foram manufaturados sob medida, adaptados do modelo utilizado na pesquisa elaborada por Reichert, dois amostradores de biofilme (Figura 1).25 Cada amostrador consistia em uma caixa de madeira contendo quatro folhas de vidro. Os amostradores foram mantidos debaixo d’água por um mês, para que o biofilme pudesse crescer adequadamente nas placas de vidro. Os amostradores foram colocados inicialmente no rio Barigui, em 22/01/2021, e foram coletadas amostras de biofilme durante três meses com periodicidade mensal: 22/02/2021 (C1), 29/03/2021 (C2) e 26/04/2021 (C3), além de amostras de água.

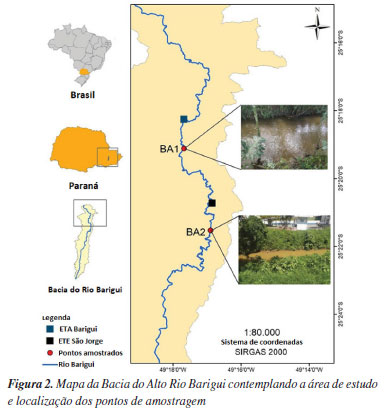
Os biofilmes foram coletados do amostrador com espátula de aço inoxidável, identificados e acondicionados em potes de vidro âmbar. Amostras de água também foram coletadas nos pontos de amostragem, identificadas e armazenadas em frascos de vidro âmbar. Todos os materiais foram previamente descontaminados com solução de HNO3- 10%. As amostras foram mantidas refrigeradas até chegarem ao laboratório, analisadas imediatamente para evitar degradação. As amostras de biofilme foram congeladas e depois liofilizadas. Além disso, os dados de precipitação do período de crescimento do biofilme foram monitorados, devido a preocupações com o desprendimento e descamação do biofilme, aumento do fluxo e da velocidade da água. Os dados foram obtidos do Instituto Águas Paraná/SIMEPAR (Sistema Paranaense de Tecnologia e Monitoramento Ambiental). A estação de monitoramento mais próxima era a “Colombo Copel”. Área de estudo O Rio Barigui tem 66 km2 e área de captação de 279 km2, localizada principalmente em áreas urbanas, atravessando as cidades de Almirante Tamandaré, Curitiba e Araucária, no sul do Brasil. Na bacia do Alto Rio Barigui existe um aquífero cárstico, atualmente utilizado como fonte de água potável para a população da região. Para proteger as nascentes do rio e do aquífero, foram criadas áreas de proteção ambiental. No entanto, a presença de áreas urbanas e indústrias ao longo do rio põe em risco a qualidade da água. A população estimada na bacia para o ano de 2020 é de aproximadamente 860 mil habitantes. Embora a maior parte da área seja abastecida por sistemas de coleta de efluentes sanitários, que constituem um sistema de esgotos separado, muitos agregados familiares não estão ligados às redes de esgotos e apenas 57% do esgoto doméstico é tratado.26 Para o presente estudo foram escolhidos dois pontos amostrais na Bacia do Alto Rio Barigui (Figura 2). O primeiro ponto amostral (BA1) após a Estação de Tratamento de Água (ETA) Barigui, que fornece água potável para a população de Almirante Tamandaré. O segundo ponto (BA2) foi amostrado após a Estação de Tratamento a Estação de Tratamento de Esgoto (ETE) São Jorge. A ETE possui reator anaeróbio seguido de tratamento físico-químico para remoção de fósforo (decantação/flotação) e trata 48,3 L s-1 de efluente, enquanto o rio tem vazão de 347,1 L s-1 no ponto de descarga.27
Para análise de água, a metodologia foi adaptada de Ide et al.28 Amostras de água (500 mL) foram filtradas (acetato de celulose, 0,45 μm) e acidificadas com HCl 6,0 mol L-1 até pH ≈ 3. Cartuchos de fase sólida adquiridos da Chromabond C18 (500 mg, 6 mL, Macherei-Nagel, Düren, Alemanha) foram condicionados com 6 mL de hexano, 6 mL de acetona, 6 mL de metanol e 6 mL de água ultrapura acidificada. As amostras foram extraídas sob vácuo em vazão de 6 a 8 mL min-1. Os cartuchos foram secos e o conteúdo foi eluído com 10 mL de acetonitrila. A alíquota foi levada até a secura utilizando gás nitrogênio, foi reconstituída em 2 mL de acetonitrila e a amostra foi armazenada pré-concentrada em vials, posteriormente injetada no cromatógrafo líquido de alta eficiência acoplado a espectrometria de massas triploquadrupolo modelo Ultivo LC-MS/MS. Para análise de biofilme a metodologia foi adaptada de Huerta et al.29 As amostras foram liofilizadas, peneiradas (120 μm) e pesadas (1 g) em tubos de polipropileno. Foram realizadas duas etapas de extração com duas alíquotas de acetonitrila (5 mL). Os solventes foram adicionados às amostras, agitados, ultrassônicos por 16 min e centrifugados a 3600 rpm por 20 min. O sobrenadante foi evaporado utilizando gás nitrogênio, reconstituído em 1 mL de acetonitrila e adicionados 250 mL de água ultrapura. As amostras foram acidificadas com HCl (até pH ≈ 3). Em seguida, a extração em fase sólida foi realizada conforme as amostras de água. Para evitar contaminação nas análises, toda a vidraria foi lavada com Extran 5%, água ultrapura, seca e cuidadosamente lavada com mistura de acetonitrila e isopropanol (1:1), sonicada e seca. Amostras em branco foram incluídas em cada lote para avaliar possíveis contaminações. Para fins de validação, amostras foram coletadas em área não urbana do rio Barigui, próximo à nascente do rio. A linearidade foi avaliada utilizando pelo menos 5 níveis de concentração em triplicatas e foi determinada através de regressão linear. O limite de detecção (LD) e o limite de quantificação (LQ) foram calculados usando o método de relação sinal-ruído (SNR). A especificidade foi determinada comparando-se uma curva de calibração feita em solvente e outra feita no eluato da matriz com mistura das amostras diluídas 1:10 pois não conseguimos encontrar uma matriz real isenta dos compostos investigados. Os resultados foram comparados pelo teste t de Student (p < 0,05, 95% de significância). A precisão entre os dias e nos dias foram avaliadas analisando três níveis de concentração no equipamento. Para as variações intra-dia foram analisadas 6 réplicas e para as variações inter-dia 3 foram analisadas replicata em 3 dias diferentes e foi aceito um desvio padrão relativo (DPR) < 20%. A recuperação foi avaliada verificando a porcentagem de analito extraído desde o início até o final de todo o processo. Foram adicionados em triplicata os analitos nas amostras para obtermos a concentração final de 5 μg L-1. Análises cromatográficas As amostras foram destinadas à análise por cromatografia em fase líquida de alta eficiência (CLAE). Os métodos cromatográficos foram desenvolvidos no equipamento da marca Agilent, modelo 1260 infinity, bomba quaternária de 600 bar, equipado com uma coluna de octadecilisiano Poroshell 120 EC-C18 (2.1 × 100 mm, 2,7 μm) com pré-coluna. O detector acoplado em série foi o espectrômetro de massas triploquadrupolo modelo Ultivo com fonte de ionização electrospray (ESI) associado a um gerador de nitrogênio modelo Genius NM32LA da marca Peak Scientific. A identificação dos compostos foi realizada utilizando os espectros de fragmentação (MS/MS), comparando com os bancos de dados do MassBank of North America (MoNA). A fase móvel utilizada foi a água ultrapura acidificada com ácido fórmico 0,04% na linha A e acetonitrila na linha C. O fluxo utilizado foi de 0,4 mL min-1 sob a temperatura de 30 ºC e o volume de 10 µL. A proporção dos solventes iniciou em 30% de A, subiu até 40% em 1 min e permaneceu até 2,50 min nesta proporção. Em 2,51 min a proporção foi aumentada para 95% permanecendo até o tempo de 7 min retornando à condição inicial aos 7,01 min. Para análises de filtros UV a fonte ESI-MS/MS foi mantida na temperatura de 300 ºC, com fluxo do gás N2 de 7 mL min-1 e pressão do nebulizador de 15 psi. A voltagem do capilar foi mantido em 4800 V. Foi realizado o monitoramento de reações múltiplas (MRM) no modo positivo.
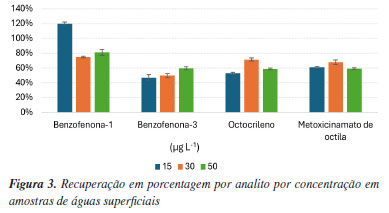
RESULTADOS E DISCUSSÕES As análises em matrizes ambientais são complexas devido a presença de compostos desconhecidos, assim como estruturas orgânicas diversas. Tal fato dificulta muito o desenvolvimento de metodologias que possam atender aos critérios e ao mesmo tempo sejam simples para que possam ser reproduzidas em outras pesquisas. Os métodos analíticos foram desenvolvidos visando estes critérios de linearidade na matriz, precisão intermediária e exatidão. Na Tabela S1 (Material Suplementar) constam os parâmetros analisados na espectrometria de massas. Estas informações permitem a reprodução do método desenvolvido por equipamentos semelhantes. Constam na tabela os valores de tempo de retenção (min), íons precursores e transições (m/z), energias de colisão (CE), fragmentor (V) e tempo de retenção por composto analisado. A Figura S1 (Material Suplementar) mostra um cromatograma típico dos analitos que foram realizados no modo MRM com seus respectivos íons de qualificação e quantificação, demonstrando sua separação com base em transições de íons e tempos de retenção. A transição mais abundante foi utilizada para quantificar o analito alvo e a segunda foi utilizada como qualificador. As transições encontradas são semelhantes às relatadas na literatura.30-32 Linearidade na matriz Os valores de limite de detecção (LD) e limite de quantificação (LQ em águas) foram determinados entre 0,05 e 0,33 μg L-1 e 0,15 e 1,11 μg L-1 respectivamente. Limites de detecção e limites de quantificação foram determinados em solvente H2O (ácido fórmico 0,04%):acetonitrila (30:70 v/v). As curvas de calibração foram construídas nas matrizes a fim de avaliar e mitigar possíveis interferências. As matrizes foram analisadas individualmente com o intuito de verificar possível interferência de cada matriz sob os analitos. Os dados dos parâmetros de linearidade, LD e LQ, faixa de trabalho e coeficiente de correlação da matriz águas superficiais foram apresentados na Tabela S2 (Material Suplementar). A Tabela S3 (Material Suplementar) apresenta os mesmos parâmetros para avaliação do biofilme. O teste de Cochran demonstrou que os compostos apresentaram dados com variância homogênea. Todos os dados apresentaram C calculado inferior a C crítico. Dessa forma, pode-se concluir através do teste de Cochran que os dados são homocedásticos e a utilização do método dos mínimos quadrados ordinários (MMQO) é apropriada. O teste F foi aplicado para verificar o coeficiente angular. Como critério, foi utilizado o F calculado sendo maior do que F crítico, considerando assim que os pontos pertenceriam a curva de calibração. O teste F da ANOVA (análise da variância), por sua vez, comprovou a significância dos coeficientes angulares. Nas Tabelas S4 e S5 (Material Suplementar) foram inseridos os resultados das análises estatísticas complementares das matrizes águas superficiais e biofilme respectivamente. O teste de Cochran permite comprovar estatisticamente a dispersão aleatória dos dados. Enquanto o teste ANOVA permite confirmar a significância da regressão linear aplicada, ou seja, é uma validação dos coeficientes aplicados nos cálculos de concentrações dos analitos nas matrizes. Os métodos desenvolvidos corresponderam de forma satisfatória de acordo com os critérios adotados pelas Diretrizes Brasileiras de Validação do Instituto Nacional de Metrologia, Qualidade e Tecnologia (Inmetro).33 Precisão intermediária O critério de aceitação conforme o Inmetro para a repetibilidade na faixa de 10 µg L-1 é de 21% de desvio padrão relativo, ou seja, 21% do desvio padrão em relação à média obtida de área nas concentrações avaliadas, normalizado para porcentagem e expressado na forma de desvio padrão relativo (DPR). As precisões intra- e inter-dias ficaram entre 0,36-7,52% e 3,00-18,86%, respectivamente. Todos os compostos atenderam aos critérios de avaliação. A Tabela S6 (Material Suplementar) apresenta os valores experimentais obtidos de desvio padrão relativo (DPR), avaliado com base nas leituras das soluções em triplicata por ponto avaliado. As variações podem ser notadas com valores mais elevados nas análises entre os dias o que é bastante coerente visto que em dias alternados a chance de maiores influências externas é maior do que em relação às análises realizadas no mesmo dia. Os resultados para repetibilidade se mostraram satisfatórios visto que todos os valores de DPR na faixa de concentração de 10-9 (ppb) ou µg L-1 aceitável é de 45% conforme DOQ-CGCRE-008 do Inmetro.33 Exatidão De acordo com as diretrizes DOQ-CGCRE-008 do Inmetro,33 os limites aceitáveis para recuperação na faixa de trabalho de ppb ou µg L-1 aceitáveis são entre 40 a 120%. A Tabela S7 (Material Suplementar) compara os valores de recuperação por composto, complementado pelo DPR por concentração. A exatidão foi avaliada com base na adição dos padrões antes do início dos procedimentos de preparo de amostras considerando o fator de pré-concentração. A recuperação foi avaliada nas matrizes águas superficiais e biofilmes. Os critérios adotados conforme o Inmetro foi de 40 a 120% de recuperação para a média das concentrações avaliadas. A recuperação mostra a tendência da exatidão do método no preparo das amostras. As eficiências de recuperação nas amostras de águas superficiais variaram de 47 a 120%. As DPR das recuperações variaram de 1 a 4%. Todos os compostos foram reprodutíveis nas concentrações avaliadas. Desta forma, os resultados demonstraram que os erros aleatórios e sistemáticos promovem certa perda dos analitos nos procedimentos de extração, no entanto, devido as baixas concentrações dos analitos os resultados podem ser aceitos e estão de acordo com as diretrizes do Inmetro. A Figura 3 compara os dados das recuperações e desvios padrões em águas superficiais por composto.
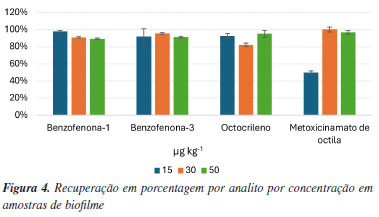
Na matriz biofilme as recuperações foram determinadas entre 50 e 100%. Todos os compostos obtiveram a recuperação de acordo com o recomendado pelo Inmetro. O composto metoxicinamato de octila sofreu certa perda no procedimento de extração das amostras na concentração de 15 µg L-1. A Figura 4 compara os dados das recuperações e desvios padrões em biofilmes por composto.
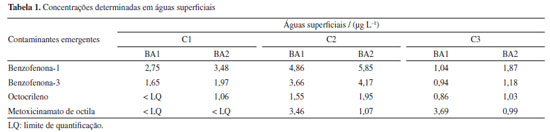
Análises de contaminantes emergentes em águas superficiais A principal fonte de contaminantes emergentes é o consumo humano. Nas estações de tratamento de esgoto (ETE) estes compostos podem ser concentrados devido as limitações na capacidade de remoção destes contaminantes da água. O ponto BA2 fica depois da ETE São Jorge, portanto o incremento destes contaminantes pode indicar alguma influência da ETE na qualidade das águas superficiais do rio Barigui. Entre as coletas 1 a 3 (C1 a C3) foi possível observar um leve incremento das concentrações dos analitos no ponto BA2 em relação ao ponto BA1, exceto para o metoxicinamato de octila. Para uma discussão complementar, foram determinadas em águas superficiais as concentrações de contaminantes emergentes no rio Barigui durante as coletas. A coleta 2 (C2) obteve as maiores concentrações dos contaminantes emergentes em águas superficiais. Os resultados foram expressos na Tabela 1.
Estudos anteriores analisaram filtros UV em rios de diversos países, inclusive do Brasil. Da Silva et al.,34 considerando o octocrileno e o metoxicinamato de octila analisados em águas superficiais de rios que são fonte de estações de tratamento de água (ETA), obtiveram resultados abaixo do LQ. No estudo realizado em reservatórios naturais na Austrália por O’Malley et al.,35 os filtros UV variaram de 7,33 µg L-1 às 13 h a 2,55 µg L-1 às 21 h. O estudo investigou diferentes possíveis rotas de degradação ao longo do tempo para quatro filtros UV. Os resultados sugeriram mudanças não significativas ao longo do tempo, propondo que o provável destino destes compostos no meio ambiente seja a dispersão. Balmer et al.36 analisaram benzofenona-3 (BP-3), metoxicinamato de octila (OMC) e octocrileno (OC) em lagos na Suíça. O objetivo da pesquisa foi a determinação da ocorrência destes compostos em águas superficiais, efluentes sanitários e peixes da região. As concentrações variaram entre < 0,002-0,02 μg L-1 para BP-3, < 0,002-0,007 μg L-1 para OMC e < 0,002-0,005 μg L-1 para OC em águas superficiais. Em estudo realizado por Ekpeghere et al.37 foram analisadas as benzofenonas e metoxicinamato de octila em águas superficiais na Coreia. A maior concentração detectada foi 0,25 μg L-1 de OMC, enquanto BP-3 atingiu 0,15 μg L-1 e benzofenona 0,04 μg L-1. O estudo correlacionou a concentração dos poluentes no afluente dos sistemas de tratamento e concluiu relação direta à densidade populacional residente. Os resultados encontrados na matriz águas superficiais neste estudo foram próximos dos estudos encontrados na literatura, propondo, assim, coerência nas análises destes compostos em águas superficiais. Análises de contaminantes emergentes em biofilme O biofilme foi avaliado com o objetivo de verificar o potencial de uma nova matriz para o monitoramento ambiental. A pesquisa propõe a utilização de uma ferramenta mais representativa. O foco foram os compostos que possam trazer preocupação quanto a sua presença nos ambientes aquáticos, porém são de difícil determinação em águas superficiais. A amostragem passiva consistiu em avaliar os contaminantes emergentes presentes na formação do biofilme durante o período de exposição, integrando temporalmente as quantidades acumuladas. Nesta pesquisa foi visualmente diferente a formação de biofilme entre os dois pontos. O ponto BA1 apresenta uma formação com aspecto mais rico de partículas, possivelmente proveniente do material particulado em suspensão natural do local de estudo, com poucos organismos vivos aparentes. Já no ponto BA2 a presença de organismos zoobentos foi muito mais abundante e o aspecto mais translúcido e viscoso. A Figura 5 demonstra a diferença entre o aspecto do biofilme do ponto BA1 em relação ao ponto BA2.

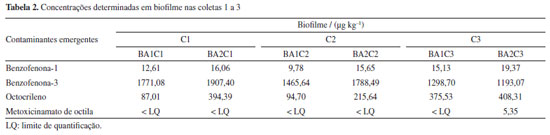
Os resultados demonstraram principalmente potencial de bioacumulação da benzofenona-3 e octocrileno. Nas três coletas analisadas os resultados foram bastante superiores em comparação aos encontrados em águas superficiais. Apenas o metoxicinamato de octila obteve resultados abaixo do limite de detecção (LD). Em todos os pontos amostrais em todas as coletas, exceto para a benzofenona-3 durante a coleta 3 foi possível observar um leve incremento de concentração dos analitos no ponto BA2 em relação ao ponto BA1. De forma geral foram superiores no ponto após a estação de tratamento de esgotos (ETE). Os resultados apresentados podem sugerir uma maior contribuição no ponto BA2 depois da ETE do que no ponto BA1 depois da ETA em relação ao incremento de contaminação emergente nos ambientes aquáticos. Na Tabela 2 foram demonstradas as concentrações de contaminantes emergentes no biofilme do rio Barigui durante as coletas.
O composto benzofefona-3 apresentou concentrações muito superiores em relação aos demais compostos. Esse comportamento foi observado tanto para o ponto BA1 quanto para o ponto BA2. Para este composto a variação foi entre 1193,07 a 1907,40 µg kg-1, ambos no ponto BA2. A variação das concentrações determinadas para os demais compostos foram de 9,78 a 16,06 µg kg-1 de benzofenona-1. Para o composto octocrileno a variação ficou entre 87,01 e 408,31 µg kg-1. Já o composto metoxicinamato de octila só pode ser quantificado no BA2C3 com 5,35 µg kg-1. A maior incidência de chuvas pode ocasionar a maior suspensão de partículas na coluna d’água. Os dados de precipitação podem ser verificados na Figura S2 no material suplementar. A maior incidência de chuvas pode ocasionar a maior suspensão de partículas na coluna d’água. O biofilme acumulou compostos hidrofóbicos (alto log Kow (razão de partição n-octanol-água)), como filtros UV. Essa capacidade de bioacumulação acontece principalmente por causa das substâncias poliméricas extracelulares (EPS) produzidas pelos microrganismos. O EPS pode atuar como um filtro, retendo cátions, ânions, compostos apolares e partículas da fase aquosa.18 Além da bioacumulação, compostos facilmente digeridos ou particionados por microrganismos podem sofrer processos de biodegradação no biofilme, o que os tornaria mais difíceis de detectar. Esta interessante capacidade de biofilme já é utilizada em processos de tratamento de águas residuais, como em biorreatores de leito móvel e outros reatores biológicos.38 Porém, a maioria dos contaminantes tóxicos possui moléculas complexas e dificilmente seriam degradadas pelos microrganismos presentes no biofilme dos rios.30 Existe a possibilidade de contaminação de outras espécies que se alimentam do biofilme, e até mesmo de biomagnificação de alguns poluentes ao longo da cadeia alimentar.30 Não encontramos dados de outros estudos para comparar o acúmulo de filtros UV no biofilme. No entanto, Mizukawa et al.39 analisaram filtros UV em amostras de sedimentos coletadas em rios próximos. As concentrações encontradas variaram até 61,8 μg kg-1 para benzofenona-1, 67,2 μg kg-1 para benzofenona-3, 322,6 μg kg-1 para octocrileno, 166,8 μg kg-1 para o metoxicinamato de octila. De acordo com a revisão da literatura, existem poucos estudos a respeito do acúmulo de poluentes no biofilme. Mais estudos devem ser realizados com diferentes classes de poluentes, especialmente contaminantes emergentes. O biofilme pode ser uma ferramenta simples para avaliação da bioacumulação de contaminantes emergentes nos ambientes aquáticos e possuem a capacidade de reter e acumular substâncias, concentrando compostos na matriz. Os resultados podem sugerir que a utilização de biofilme para biomonitoramento ambiental passivo pode ser de grande valia quando se trata de moléculas alvo. Outras classes de contaminantes emergentes devem ser investigadas e moléculas alvos devem ser propostas para a construção de um banco de dados mais diversificado.
CONCLUSÕES O presente estudo obteve resultados positivos em relação a validação dos métodos cromatográficos tanto na água quanto para o biofilme. Como principal contribuição, esta pesquisa mostrou que o biofilme foi capaz de crescer no amostrador produzido e pode atuar como nova ferramenta de monitoramento em ambientes aquáticos. O monitoramento da qualidade dos ambientes aquáticos analisando somente a matriz águas superficiais poderia sugerir que o rio sofre pouco impacto devido as relações antrópicas. No entanto, agregando as análises de biofilme podemos levantar a possibilidade de impactos maiores em relação a matriz águas superficiais. A bioacumulação apresentada neste estudo demonstrou que os biofilmes podem ser ferramentas muito úteis no monitoramento, pois são naturalmente disponíveis e integram a exposição crônica. Para os compostos analisados foi possível observar a bioacumulação, principalmente, da benzofenona-3. O biofilme é uma mistura complexa de organismos vivos e compostos químicos, mostrando ser vantajoso no biomonitoramento dos compostos analisados, principalmente, por permitirem o registro de monitoramento por um dado período. Em relação as águas superficiais que registra somente um momento específico, o biofilme se mostrou mais significativo para o monitoramento da qualidade dos ambientes aquáticos.
MATERIAL SUPLEMENTAR Estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo pdf, com acesso livre, as tabelas de estatística descritiva dos resultados de qualidade das águas investigadas, bem como as comparações com os limites estabelecidos pela Legislação Brasileira vigente.
AGRADECIMENTOS Fundação Araucária pela concessão da bolsa técnica atuante no Laboratório Multiusuário de Equipamentos e Análises Ambientais (LAMEAA) da UTFPR pelo período de dois anos e meio em dois ciclos. FUNTEF pelo equipamento LC-MS/MS Projeto FINEP 01.14.0152.03 Subprojeto NIPTA.
REFERÊNCIAS 1. Gwenzi, W.; Kanda, A.; Muhoyi, E.; Mukura, T. J. In Emerging Contaminants in the Terrestrial-Aquatic-Atmosphere Continuum: Occurrence, Health Risks and Mitigation; Gwenzi, W., ed.; Elsevier: Amsterdam, Oxford, Cambridge, 2022, p. 17. [Crossref] 2. Li, B.; Xu, D.; Zhou, X.; Yin, Y.; Feng, L.; Liu, Y.; Zhang, L.; Environ. Res. 2023, 227, 115709. [Crossref] 3. Mishra, R. K.; Mentha, S. S.; Misra, Y.; Dwivedi, N.; Water-Energy Nexus 2023, 6, 74. [Crossref] 4. Duis, K.; Junker, T.; Coors, A.; Sci. Total Environ. 2022, 808, 151931. [Crossref] 5. Ghazipura, M.; McGowan, R.; Arslan, A.; Hossain, T.; Reprod. Toxicol. 2017, 73, 175. [Crossref] 6. Canela, M. C.; Jardim, W. F.; Sodré, F. F.; Grassi, M. T.; Cafeína em Águas de Abastecimento Público no Brasil; Editora Cubo: São Carlos, 2014. 7. Karthigadevi, G.; Manikandan, S.; Karmegam, N.; Subbaiya, R.; Chozhavendhan, S.; Ravindran, B.; Chang, S. W.; Awasthi, M. K.; Bioresour. Technol. 2021, 324, 124678. [Crossref] 8. de Oliveira, M.; Frihling, B. E. F.; Velasques, J.; Magalhães Filho, F. J. C.; Cavalheri, P. S.; Migliolo, L.; Sci. Total Environ. 2020, 705, 135568. [Crossref] 9. Sengar, A.; Vijayanandan, A.; Sci. Total Environ. 2022, 807, 150677. [Crossref] 10. Srain, H. S.; Beazley, K. F.; Walker, T. R.; Environ. Rev. 2021, 29, 142. [Crossref] 11. Stefanac, T.; Grgas, D.; Dragičević, T. L.; J.Xenobiot. 2021, 11, 130. [Crossref] 12. Chiriac, F. L.; Paun, I.; Pirvu, F.; Iancu, V.; Galaon, T.; New J. Chem. 2021, 45, 2478. [Crossref] 13. Vela-Soria, F.; Jiménez-Díaz, I.; Rodríguez-Gómez, R.; Zafra-Gómez, A.; Ballesteros, O.; Navalón, A.; Vílchez, J. L.; Fernández, M. F.; Olea, N.; Talanta 2011, 85, 1848. [Crossref] 14. Magee, H. Y.; Maurer, M. M.; Cobos, A.; Adhikari, S.; Halden, R. U.; Sci. Total Environ. 2023, 892, 164425. [Crossref] 15. Pandey, A.; Organic and Medicinal Chemistry - International Journal 2017, 3, 555614. [Crossref] 16. McDougald, D.; Rice, S. A.; Barraud, N.; Steinberg, P. D.; Kjelleberg, S.; Nat. Rev. Microbiol. 2012, 10, 39. [Crossref] 17. Battin, T. J.; Besemer, K.; Bengtsson, M. M.; Romani, A. M.; Packmann, A. I.; Nat.Rev. Microbiol. 2016, 14, 251. [Crossref] 18. Flemming, H.-C.; Wingender, J.; Nat. Rev. Microbiol. 2010, 8, 623. [Crossref] 19. Desiante, W. L.; Minas, N. S.; Fenner, K.; Water Res. 2021, 193, 116846. [Crossref] 20. Fuchs, S.; Haritopoulou, T.; Schäfer, M.; Wilhelmi, M.; Water Sci. Technol. 1997, 36, 277. [Crossref] 21. Kohusová, K.; Havel, L.; Vlasák, P.; Tonika, J.; Environ. Monit. Assess. 2011, 174, 555. [Crossref] 22. Sentenac, H.; Loyau, A.; Leflaive, J.; Schmeller, D. S.; Funct. Ecol. 2022, 36, 294. [Crossref] 23. Proia, L.; Osorio, V.; Soley, S.; Köck-Schulmeyer, M.; Pérez, S.; Barceló, D.; Romaní, A. M.; Sabater, S.; Environ. Pollut. 2013, 178, 220. [Crossref] 24. Reichert, G.; Hilgert, S.; Fuchs, S.; Azevedo, J. C. R.; Environ. Pollut. 2019, 255, 113140. [Crossref] 25. Reichert, G.; Hilgert, S.; Alexander, J.; de Azevedo, J. C. R.; Morck, T.; Fuchs, S.; Schwartz, T.; Sci. Total Environ. 2021, 768, 144526. [Crossref] 26. Sistema Nacional de Informações Sobre Saneamento (SNIS); Diagnóstico Temático - Serviços de Água e Esgoto; Ministério das Cidades. Secretaria Nacional de Saneamento Ambiental (SNSA): Brasília, 2023. [Link] acessado em outubro 2024 27. Agência Nacional de Águas e Saneamento Básico (ANA); Atlas Esgotos: Despoluição de Bacias Hidrográficas; Sistema Nacional de Informações sobre Recursos Hídricos: Brasília, 2017. [Link] acessado em outubro 2024 28. Ide, A. H.; Osawa, R. A.; Marcante, L. O.; Pereira, J. C.; de Azevedo, J. C. R.; Clean: Soil, Air, Water 2017, 45, 1700334. [Crossref] 29. Huerta, B.; Rodriguez-Mozaz, S.; Nannou, C.; Nakis, L.; Ruhí, A.; Acuña, V.; Sabater, S.; Barcelo, D.; Sci. Total Environ. 2016, 540, 241. [Crossref] 30. Gago-Ferrero, P.; Díaz-Cruz, M. S.; Barceló, D.; Anal. Methods 2013, 5, 355. [Crossref] 31. Jedziniak, P.; Szprengier-Juszkiewicz, T.; Pietruk, K.; Śledzińska, E.; Żmudzki, J.; Anal. Bioanal. Chem. 2012, 403, 2955. [Crossref] 32. Magi, E.; Di Carro, M.; Scapolla, C.; Nguyen, K. T. N.; Chromatographia 2012, 75, 973. [Crossref] 33. Centro de Desenvolvimento da Tecnologia Nuclear (CDTN), DOQ-CGCRE-008 Revisão 09, Orientação sobre Validação de Métodos Analíticos. [Link] acessado em outubro 2024. 34. da Silva, T. F. B. X.; Ramos, D. T.; Dziedzic, M.; de Oliveira, C. M. R.; de Vasconcelos, E. C.; Water, Air, Soil Pollut. 2011, 218, 611. [Crossref] 35. O’Malley, E.; McLachlan, M. S.; O’Brien, J. W.; Verhagen, R.; Mueller, J. F.; Sci. Total Environ. 2021, 754, 142373. [Crossref] 36. Balmer, M. E.; Buser, H. R.; Müller, M. D.; Poiger, T.; Environ. Sci. Technol. 2005, 39, 953. [Crossref] 37. Ekpeghere, K. I.; Kim, U.-J.; O, S.-H.; Kim, H.-Y.; Oh, J.-E.; Sci. Total Environ. 2016, 542, 121. [Crossref] 38. El-taliawy, H.; Casas, M. E.; Bester, K.; J.Hazard. Mater. 2018, 347, 288. [Crossref] 39. Mizukawa, A.; Molins-Delgado, D.; de Azevedo, J. C. R.; Fernandes, C. V. S.; Díaz-Cruz, S.; Barceló, D.; Environ. Sci. Pollut. Res. 2017, 24, 18284. [Crossref]
Editor Associado responsável pelo artigo: Boniek G. Vaz |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access