Artigo
|
|
| Preparação de biocompósito à base de amido termoplástico reforçado com fibras de eucalipto: avaliação do efeito do tamanho das fibras nas propriedades mecânicas e de sorção Preparation of biocomposite based on thermoplastic starch reinforced with eucalyptus fibers: evaluation of fibers size effect on mechanical and sorption properties |
|
Luisa B. dos Santos Departamento de Química, Centro de Ciências Exatas (DQUI/CCE), Universidade Federal do Espírito Santo, 29075-910 Vitória - ES, Brasil Recebido: 01/04/2024 *e-mail: cleocir.dalmaschio@ufes.br This study investigated the preparation of a thermoplastic starch-based (ATP) biocomposite reinforced with eucalyptus fibers (FE), focusing on how fiber size affects the properties. The natural fibers were chemically processed using alkaline and bleaching treatments of eucalyptus bark. Subsequently, they were characterized by infrared spectroscopy (FTIR) and X-ray diffraction (XRD) to evaluate alterations in fiber composition and crystalline structure. Samples of biocomposites were prepared with a fixed fiber content (20 wt.%) and variations in particle size (dp): ATP/FE600 (600 μm ≤ dp < 1180 μm), ATP/FE250 (250 μm ≤ dp < 600 μm), and ATP/FE75 (75 μm ≤ dp < 250 μm). The samples were characterized by optical and scanning electron microscopy, mechanical tests, moisture absorption, and swelling analysis. Results indicated significant effects of fiber size on the biocomposite properties. Notably, the larger fibers present in
ATP/FE600 exhibited superior tensile strength and elastic modulus, while this sample demonstrated reduced moisture absorption and swelling tendencies. Microscopic images revealed enhanced matrix-fiber adhesion in ATP/FE600, highlighting the importance of proper fiber size. The optimization of fiber size emerges as a relevant strategy for improving the mechanical attributes and mitigating moisture/water absorption tendencies in starch-based thermoplastic biocomposites, contributing to sustainable and high-performance materials. INTRODUÇÃO O rápido progresso tecnológico e econômico experimentado pela sociedade global após a Segunda Guerra Mundial foi fortemente impulsionado pelo crescimento da indústria de plásticos. Reconhecido por apresentar propriedades singulares em um único material (e.g. durabilidade, maleabilidade, impermeabilidade a líquidos, resistência à degradação física e química e baixo custo), o plástico é um produto versátil que desempenha papel fundamental em diversos setores industriais.1,2 Entretanto, por ser um polímero sintético de origem fóssil e natureza não-biodegradável, a produção e o consumo descontrolados desse material associado ao seu descarte inadequado vêm causando graves problemas ambientais, como por exemplo: impactos na vida marinha e terrestre, agravamento da crise climática e questões de saúde, como anormalidades reprodutivas, alterações endócrinas e até mesmo em diagnósticos de câncer.3,4 Diante deste cenário, especial atenção tem sido dada a busca por alternativas que promovam a sustentabilidade e minimizem os impactos negativos gerados pelo uso dos plásticos. Essa iniciativa está alinhada com os Objetivos de Desenvolvimento Sustentável (ODS), criados em 2015 pela Organização das Nações Unidas (ONU). Os 17 objetivos estabelecidos visam orientar esforços mundiais na promoção de um desenvolvimento sustentável e inclusivo até o ano de 2030.5 Medidas já vêm sendo adotadas com a finalidade de cumprir tal propósito. Um exemplo são as restrições ao consumo de plásticos de uso único (e.g. canudos, copos e talheres) praticadas por países da Europa, que estão de acordo com o ODS 12 (Consumo e Produção Responsáveis). Já os ODS 9 (Indústria, Inovação e Infraestrutura) e ODS 15 (Vida Terrestre) estão em consonância com a busca por materiais alternativos, como os polímeros naturais (também chamados de biopolímeros), fabricados a partir de fontes naturais e renováveis, como os polissacarídeos (amido, celulose, lignina, etc.) e proteínas (caseína, colágeno, glúten, etc.).5-7 O amido se destaca como opção promissora de biopolímero para a fabricação de materiais ecologicamente corretos, uma vez que é abundante, biodegradável e apresenta baixo custo. Quando submetido a um tratamento térmico na presença de agentes plastificantes, o amido passa por um processo de gelatinização, transformando-se em amido termoplástico (ATP).8 Os agentes plastificantes (como água, glicerol, sorbitol, etc.) desempenham papel fundamental na formulação do amido termoplástico. Sua adição leva a diminuição das forças intermoleculares entre as cadeias de amilose e amilopectina (macromoléculas que constituem o grânulo de amido) e resultam, de forma síncrona, em ligações de hidrogênio entre o plastificante e as hidroxilas do amido. A partir dessa interação, ocorre a diminuição da temperatura de transição vítrea (Tg) do ATP, melhorando sua mobilidade e contribuindo para o aumento da flexibilidade do material.8,9 Entretanto, o ATP apresenta algumas desvantagens quando comparado aos plásticos convencionais, tais como natureza hidrofílica, baixa resistência a tração e, propriedades de barreira e estabilidade térmica limitadas. Para melhorar as suas características e agregar mais funcionalidades, outros biopolímeros (celulose, lignina, amido, etc.) podem ser adicionados à matriz termoplástica com a finalidade de reforçá-la.7-10 Neste sentido, diversos estudos11-21 têm se dedicado a investigar reforços de origem renovável a base de celulose, formando materiais constituídos de fases de origem natural conhecidos como biocompósitos. O Brasil destaca-se de forma significativa neste contexto, já que apresenta extensa área territorial cultivável dominada por pequenas e grandes propriedades rurais geradoras de grandes volumes de resíduos agrícolas, os quais podem ser aproveitados como fontes de amido e celulose. Além disso, a produção de celulose comercial no país alcançou o segundo maior volume registrado, totalizando aproximadamente 25 milhões de toneladas ao longo do ano de 2022, refletindo o contínuo crescimento e desenvolvimento do setor. Segundo projeções do Ministério da Agricultura e Pecuária (MAPA), espera-se um crescimento médio anual de 2,4% do agronegócio no período de 2021 a 2031. Paralelamente a essa extensa produção, mais de 57% de resíduos do tipo cascas, galhos e folhas são gerados, podendo ser reaproveitados e aplicados a produção de fibras como cargas de reforço para a produção dos biocompósitos.22-24 Outro fator crucial está relacionado à escolha de um plastificante natural para a produção do biocompósito, uma vez que sua presença é fundamental na produção do ATP. Nesse sentido, o glicerol se enquadra como opção sustentável, uma vez que é obtido como subproduto da indústria de biodiesel, apresentando baixo valor comercial e quantidades excedentes de produção.25 Na literatura, poucos trabalhos26-29 avaliam a variação de granulometria das fibras e o seu impacto nas propriedades dos biocompósitos. Assim, este estudo teve o objetivo de preparar um biocompósito de amido termoplástico de mandioca reforçado com fibras de celulose obtidas da casca do eucalipto. Foram realizadas análises para avaliar o efeito da granulometria das fibras nas características e propriedades mecânicas do biomaterial produzido, incluindo análises de difração de raios X (DRX), espectroscopia de absorção no infravermelho por transformada de Fourier (FTIR), ensaio mecânico, testes de avaliação de grau de intumescimento, absorção de umidade e microscopias óptica e eletrônica de varredura (MEV).
PARTE EXPERIMENTAL Materiais O resíduo de casca de eucalipto foi doado pela empresa Suzano S.A. O amido de mandioca foi adquirido da empresa Indústria e Comércio de Fécula O Linda Ltda. (Nova Londrina, PR, Brasil). Foram utilizados os seguintes reagentes: glicerol P.A. 99,5% (Neon, Suzano, SP, Brasil), hidróxido de sódio em lentilhas P.A. 97% (Neon, Suzano, SP, Brasil), peróxido de hidrogênio 35% (Neon, Suzano, SP, Brasil), ácido esteárico P.A. 95% (Dinâmica, Suzano, SP, Brasil), álcool etílico P.A. 99,5% (Dinâmica, Suzano, SP, Brasil) e cloreto de sódio P.A. 99% (Dinâmica, Suzano, SP, Brasil). Para a separação granulométrica das fibras, utilizou-se um conjunto de peneiras (Bertel, Caieiras, SP, Brasil) com abertura conforme norma ISO 3310/1.30 Metodologia Obtenção das fibras de eucalipto tratadas Inicialmente, a casca de eucalipto (FE0) foi submetida a um tratamento alcalino de acordo com a metodologia proposta por Lago et al.31 e Kamaruddin et al.,32 com algumas modificações. Para isso, 70 g de casca, moída e peneirada (tamanho de partícula, dp < 1180 μm), foram adicionadas a 1 L de solução aquosa de NaOH 5% (m/v), que foi mantida a 80 ºC sob constante agitação (300 rpm) durante 90 min. Ao término do tratamento, a suspensão foi filtrada e lavada com água destilada até que o pH atingisse um valor próximo ao da água destilada utilizada na lavagem. O material obtido (FE1) foi seco em estufa a 65 ºC por 48 h. Em seguida, realizou-se o branqueamento das fibras seguindo o procedimento proposto por Bessa et al.,33 com algumas modificações. Foram adicionados 50 g da fibra tratada na etapa anterior a 1 L de solução aquosa de H2O2 14% (v/v). Gotejou-se uma solução aquosa de NaOH 3% (m/v) até atingir pH em torno de 8 e, na sequência, a mistura foi agitada a 150 rpm durante 90 min a uma temperatura de 70 ºC. Ao final, a suspensão foi filtrada e lavada com água destilada até atingir pH semelhante ao da água destilada. O material obtido (FE2) foi seco em estufa a 65 ºC por 48 h. As fibras tratadas foram trituradas utilizando processador Lenoxx PMP435 e peneiradas de modo a obter três faixas granulométricas: (i) 600 μm ≤ dp < 1180 μm; (ii) 250 μm ≤ dp < 600 μm; (iii) 75 μm ≤ dp < 250 μm. Obtenção das pré-misturas Inicialmente, o amido de mandioca foi previamente seco em estufa a 105 ºC durante 24 h. Em seguida, o amido foi misturado manualmente ao glicerol, 30% (m/m), até completa incorporação. Adicionou-se as fibras de eucalipto tratadas, no teor de 20% (m/m), proporcional a massa de amido seca, nos tamanhos selecionados na etapa anterior, misturando manualmente. As pré-misturas foram armazenadas em sacolas plásticas termo seláveis durante 72 h, a temperatura ambiente, para completa incorporação do plastificante (glicerol) ao amido. Processamento da pré-mistura A pré-mistura foi processada empregando o método de termocompressão. Para desmoldar o biocompósito, uma solução etanólica de ácido esteárico (2 g L-1) foi, previamente, aspergida sobre as placas de alumínio de modo a formar uma fina camada. Em seguida, a pré-mistura foi acomodada em um molde quadrado de 3,2 mm de espessura e comprimida durante 90 min, utilizando uma prensa hidráulica Carver 4389 mantida a 150 ºC e sob pressão de 11 ton m-2. Os biocompósitos obtidos foram denominados: ATP (sem fibra), ATP/FE600 (600 μm ≤ dp < 1180 μm), ATP/FE250 (250 μm ≤ dp < 600 μm) e ATP/FE75 (75 μm ≤ dp < 250 μm) Análises de caracterização das fibras tratadas Difração de raios-X (DRX) Foi realizada a análise de difração de raios-X em difratômetro equipado com fonte de radiação Cu Kα (comprimento de onda = 0,154 nm) operando a 40 kV e 40 mA. O padrão de DRX foi registrado na faixa angular 2θ = 10-50º, à temperatura ambiente. O índice cristalinidade relativa (IC) foi calculado de acordo com a Equação 1, proposta por Segal et al.:34  onde I002 é a intensidade estimada pela altura do pico do material cristalino (22,5º) e Iam é a intensidade da banda estimada pela intensidade associada ao material amorfo. Espectroscopia de absorção no infravermelho com transformada de Fourier (FTIR) Realizou-se as análises de FTIR a fim de investigar os grupos funcionais presentes nas amostras de fibras. Os espectros de FTIR foram adquiridos em um espectrômetro Agilent Cary 630, empregando o modo de refletância total atenuada (ATR) com cristal horizontal de seleneto de zinco (ZnSe). A análise foi realizada com resolução de 2 cm-1 no intervalo entre 4000 a 650 cm-1. Análises de caracterização dos biocompósitos Ensaio de tração O ensaio foi realizado seguindo a norma ASTM D638-2235 para testes de tração em polímeros. Os corpos de prova do tipo I foram testados utilizando célula de carga de 500 N e velocidade de ensaio de 5 mm min-1, sem aplicação de preload. Para realizar o ensaio, os corpos de prova foram testados utilizando uma máquina universal LLOYD Instruments, modelo LR5K. Determinou-se a resistência a tração, módulo de elasticidade e o alongamento na ruptura a partir das curvas de tensão versus deformação. Os valores reportados são médias com os desvios obidos a partir do ensaio de pelo menos 5 corpos de prova. Absorção de umidade Conforme a norma ASTM E104,36 os testes de absorção de umidade foram realizados em recipiente hermeticamente fechado, contendo uma solução saturada de NaCl (20 ± 0,5 ºC) para manter o ambiente com umidade relativa controlada de 75 ± 2%. Os corpos de prova (20 × 20 × 3,2 mm) foram colocados dentro do recipiente e pesados em balança analítica, em intervalos de tempo pré-determinados, até atingirem massa constante. A quantidade de umidade absorvida (AA%) foi calculada de acordo com a Equação 2: 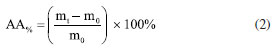 onde m0 é a massa do material antes de exposto ao ambiente com umidade controlada e mt a massa do material após um intervalo de tempo de exposição ao ambiente controlado. Os dados foram obtidos em triplicata. Grau de intumescimento Para avaliar o intumescimento dos biocompósitos quando em contato com a água, foram preparados corpos de prova de dimensões 20 × 20 × 3,2 mm. Antes do teste, foram colocados em estufa a 60 ºC por 8 h. Em seguida, as amostras foram submersas em água a temperatura ambiente de 20 ºC por um período de 2 h. A espessura foi medida, com auxílio de um paquímetro digital, antes e depois do período de submersão para determinar o grau de intumescimento (GI), conforme a Equação 3: 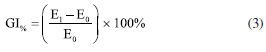 onde E1 é a espessura do corpo de prova após os tempos de imersão em água e E0, a espessura do material inicial. Os valores foram obtidos por meio das médias, com seus respectivos desvios, a partir das análises em triplicada. Microscopia ótica A incorporação, diâmetro, comprimento e distribuição das fibras de eucalipto nos biocompósitos foram analisadas utilizando um estéreo microscópio Leica™ S8 APO com uma câmera MC170 HD acoplada. Para caracterização das fibras foram obtidas imagens em microscópio Leica EZ4 HD com as fibras dispersas em lâmina de microscopia. Para determinação de comprimento e diâmetro foi utilizado o software Image J.37 A distribuição de tamanho das fibras foi avaliada a partir do comprimento médio dividido pelo desvio padrão do comprimento, sendo realizada a análise para cada uma das três faixas de tamanhos utilizados nos biocompósitos. Os valores reportados são médias com os desvios obtidos a partir da contagem de pelo menos 100 partículas. Microscopia eletrônica de varredura As imagens de microscopia eletrônica de varredura (MEV) foram obtidas pelo equipamento JEOL, modelo JSM6610LV. Os corpos de prova foram revestidos com ouro e observados no MEV utilizando voltagem de aceleração de 20 kV. Foram analisadas a superfície e a fratura das amostras, sendo que, para obter as fraturas, as amostras foram resfriadas em nitrogênio líquido e, então, clivadas. As amostras foram metalizadas com ouro, utilizando a técnica de sputtering, para aumentar a condutividade elétrica da superfície, e assim possibilitar as análises de MEV.
RESULTADOS E DISCUSSÃO Efeitos dos tratamentos realizados com a fibra de eucalipto Espectroscopia de absorção no infravermelho com transformada de Fourier (FTIR) A espectroscopia por infravermelho (FTIR) pode ser utilizada na caracterização de fibras lignocelulósicas devido à presença de bandas características de seus constituintes. Como forma de identificá-las, realizou-se a análise para as amostras de fibras sem tratamento (FE0), com tratamento alcalino (FE1) e fibras branqueadas (FE2), apresentadas na Figura 1.
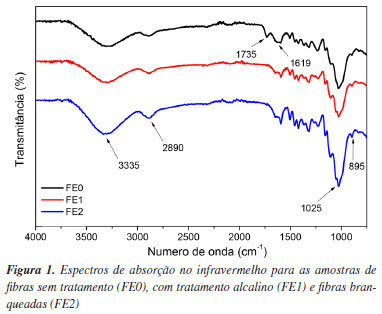
Os espectros mostram bandas de absorção características da lignina, hemicelulose e celulose. Esses componentes são formados por grupos funcionais que contêm oxigênio (tais como ésteres, cetonas e álcoois), grupamentos alifáticos e, no caso da lignina, grupamentos aromáticos. São observadas bandas de absorção na região em torno de 3335 cm-1, referentes ao estiramento das ligações O‒H, presentes na celulose e hemicelulose. Picos de intensidade mais baixa, na região de 2890-2875 cm-1, são típicos de estiramentos simétricos e assimétricos das ligações C‒H de cadeias alifáticas, além de outros na região entre 1650 a 900 cm-1, referentes às unidades de repetição de celulose e hemicelulose além de vibrações de estiramento e flexão de grupos pertencentes a lignina (vide Tabela 1S do Material Suplementar). A banda de forte intensidade, nos três espectros, na região de 1025 cm-1 indica a presença de ligações C‒O, provenientes de grupo éster. Além disso, é possível notar nos espectros das amostras FE1, FE2 a ausência do pico em 1735 e 1619 cm-1 referente ao estiramento C=O dos grupos acetil e carboxila (presentes na hemicelulose) e C=C de grupos aromáticos (presente na lignina). A ausência desses picos, após o tratamento alcalino, indica a solubilização da lignina e quebra de moléculas da hemicelulose.32,38 Difração de raios-X (DRX) Para complementar a análise de FTIR, realizou-se a caracterização por DRX nas fibras. Os difratogramas podem ser observados na Figura 2.
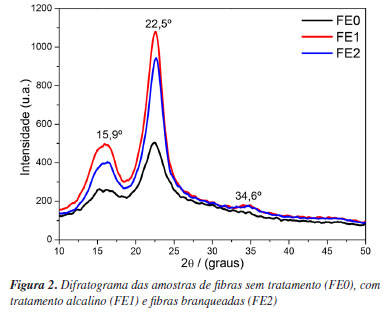
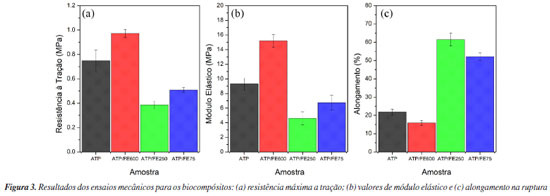
Observa-se nas 3 amostras a presença dos picos característicos da celulose (tipo I), conforme ficha cristalográfica COD 4114382,39 em 2θ = 15,9º, 22,5º e 34,6º. Sabe-se que tratamentos químicos podem levar a conversão da celulose tipo I em tipo II, que apresenta estrutura mais estável e organizada. Contudo, a análise do difratograma não apresenta o dubleto em aproximadamente 2θ = 22,6º, que seria indicativo desse tipo de transformação.40-42 Assim, infere-se que o tratamento alcalino e o branqueamento não afetaram a estrutura cristalina da celulose. O índice de cristalinidade foi calculado conforme a Equação 1 e é mostrado na Tabela 1. Para as amostras tratadas (FE1 e FE2), os índices de cristalinidade foram maiores que o obtido para a fibra sem tratamento, indicando a diminuição de componentes amorfos presentes nas fibras, como hemicelulose, lignina, ceras e outros componentes não-cristalinos, acarretando no aumento da intensidade e estreitamento dos picos de celulose.32 Os valores de cristalinidade obtidos foram próximos a de outras fibras tratadas já estudadas19,32,43,44 e utilizadas em biocompósitos. Caracterização dos biocompósitos Ensaio de tração Na Figura 3 estão apresentados os resultados de resistência a tração, módulo elástico e alongamento, respectivamente, para os diferentes biocompósitos produzidos. As curvas representativas de tensão vs. deformação são indicadas na Figura 1S, Material Suplementar.
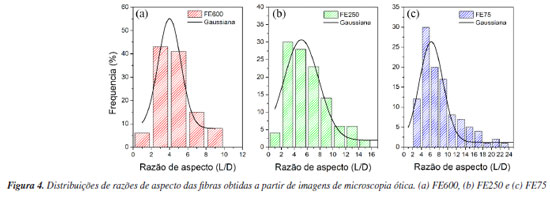
Entre os resultados apresentados, o biocompósito ATP/FE600 mostrou maior valor de tensão máxima (0,97 MPa), além de possuir maior módulo elástico (15,20 MPa) e menor alongamento (15,82%). Enquanto a amostra de ATP/FE250 apresentou menor módulo elástico (4,60 MPa) e maior alongamento (61,48%), assumindo característica dúctil quando comparada aos outros corpos de prova. Pode ser observado que as fibras com maior granulometria atuaram de forma mais eficaz como reforço estrutural no biocompósito, provocando aumento de resistência em virtude da melhor distribuição de cargas durante o ensaio de tensão (bridging).45,46 Quando as fibras possuem maior comprimento, a sua resistência é transferida à matriz que passa a suportar maiores valores de tensão.47 Quando o comprimento da fibra diminui, a resistência tende a diminuir, uma vez que a ruptura do corpo de prova será influenciada pela dispersão das espécies adicionadas.28 Assim, em compósitos com a mesma fração em massa de reforço, quando as fibras são curtas o efeito físico de dissipação de força tende a ser pouco evidente e a resistência a tração diminui se comparado a matriz com fibras mais longas. Porém, a maior quantidade numérica de fibras por unidade de volume em amostras com fibras menores atua interrompendo a propagação da fratura e eleva o alongamento.28 Em biocompósitos com maior quantidade de fibras o rompimento do corpo de prova ocorre através de multiplas fissuras, permitindo maiores alongamentos.48 O módulo de elasticidade define a capacidade do material em se deformar reversivelmente durante o ensaio de tensão e pode ser extremamente útil para descrever a resistência dos biocompósitos à deformação. No geral, os biocompósitos reforçados com fibras tendem a apresentar maior módulo de elasticidade quando comparados com a base polimérica, devido à maior rigidez das fibras incorporadas.45 Para biocompósitos, o valor do módulo elástico é influenciado pelo módulo da fibra, módulo da matriz, orientação das espécies, fração volumétrica, comprimento da fibra e dispersão da fibra na matriz. De acordo com Thomason e Vlug,49 quanto maior o comprimento da fibra, maior o módulo de elasticidade do biocompósito, o que entra em concordância com os resultados expostos (Figura 3b). Entre os compósitos ATP/FE250 e ATP/FE75 o efeito de aglomeração pode ser associado ao desvio do comportamento entre essas duas amostras. Foram realizadas medidas de comprimento (L) e diâmetro (D) das fibras e determinou-se a razão de aspecto para as amostras ATP/FE600, ATP/FE250 E ATP/FE75. Os gráficos para as distribuições da razão de aspecto (L/D) são apresentados na Figura 4. Informações complementares, como comprimento médio, diâmetro e razão de aspecto, estão dispostas no Material Suplementar (Tabela 2S).
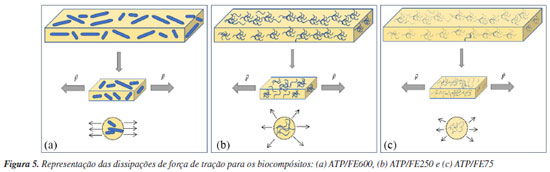
As faixas de tamanhos de partícula avaliadas influenciam diretamente nas propriedades mecânicas dos corpos de prova. Comparando as amostras ATP/FE250 e ATP/FE75, observa-se que, para a faixa de distribuiçao mais estreita (ATP/FE75, 75 μm ≤ dp < 250 μm), a resistência e o módulo elástico aumentam. Neste caso, é possível que a maior concentração numérica de fibra por unidade volume, ainda que haja formação de aglomerados, resulte em um aumento nas duas propriedades. Assim, para essas duas faixas de tamanho de fibras o efeito numérico supera o efeito de aglomeração elevando as propriedades. Por fim, a amostra de ATP/FE600 (ATP/FE600, 600 μm ≤ dp < 1180 μm) apresenta menor razão de aspecto, melhor dispersão e maior adesão interfacial, contribuindo para valores maiores de resistência à tração e módulo de elasticidade.28 A matriz de ATP sem fibra apresentou maior resistência a tração (0,75 MPa) e módulo elástico (9,29 MPa) que as fibras de menor granulometria (ATP/FE250 e ATP/FE75). O maior valor de desvio padrão nos valores de alongamento para as duas amostras de menor granulometria (ATP/FE250, 3,55% e ATP/FE75, 2,02%) sugere a formação de aglomerados durante o preparo, o que reforça a hipótese de efeitos de aglomeração e de concentração numérica indicados. Esses aglomerados podem gerar pontos de fragilidade em torno do corpo de prova, impactando negativamente a transferência da força de reforço para o amido. Esse fenômeno pode resultar em uma distribuição não uniforme das cargas de reforço ao longo do material, comprometendo suas propriedades mecânicas e a coesão entre os componentes do biocompósito. Essa relação pode ser representada na Figura 5.
A maior adesão das fibras, representada na Figura 5a, promove maior transferência de força da fibra para a matriz, ocasionando em maior resistência à deformação. Isso acontece pois, por possuir o maior tamanho, sua dispersão na matriz ocorre de forma paralela ao plano do corpo de prova, gerando maior resistência na mesma direção da força de tração utilizada no ensaio mecânico. Para a representação, Figura 5b, essa transferência de força é prejudicada pois o menor comprimento das fibras pode levar ao posicionamento aleatório das fibras na matriz tanto nos planos perpendiculares quanto paralelos a superfície e a direção de aplicação da tração, reduzindo a resistência e o módulo elástico. Dessa forma, a transferência de força da matriz deixa de ser concentrada no plano da amostra e na direção da força de tração realizada pelo ensaio, diminuindo o efeito de reforço. Por fim, na representação da Figura 5c, a menor faixa de tamanho (ATP/FE75, 75 μm ≤ dp < 250 μm) e maior razão de aspecto indicam que as fibras mais finas tendem a se orientar mais no plano paralelo à superfície do que no plano perpendicular. Essa orientação favorece a transferência de força da fibra para a matriz em direções mais alinhadas com a força de tração aplicada, resultando em maior resistência quando comparada à Figura 5b. Morfologia A Figura 6 exibe micrografias dos biocompósitos obtidos a partir da fibra branqueada com amido termoplástico. As imagens foram obtidas por meio de microscopia estereoscópica com iluminação refletida e microscópio eletrônico de varredura. Uma análise comparativa das imagens para as diferentes amostras revela características distintas em relação à uniformidade da superfície e à incorporação das fibras na matriz de amido termoplástico.
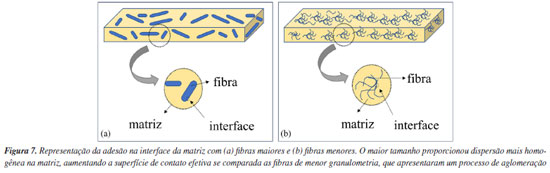
A análise dessas imagens revela que a amostra ATP/FE600 apresenta uma superfície mais uniforme, sem evidência de defeitos de preenchimento ou irregularidades visíveis e com uma incorporação efetiva das fibras na matriz de ATP. Na Figura 6Aa, a seta destaca uma fibra incorporada à matriz e, na Figura 6Ab, a seta indica uma região de preenchimento entre fibras com a matriz de ATP. As Figuras 6Ac e 6Ad representam regiões mais detalhadas e com maior magnificação. A Figura 6Ae indica uniformidade da superfície em região mais ampla e, na Figura 6Af, o relevo na superfície (destacada pela elipse na imagem) demonstra como a matriz de ATP recobre totalmente a fibra. As Figuras 6Ag e 6Ah representam a fratura com a presença das fibras de reforço e a seta da Figura 6Ah destaca a adesão da matriz com a fibra. Por outro lado, na amostra ATP/FE250 (Figuras 6Ba-6Bh) podem ser visualizadas em algumas áreas falhas de preenchimento, representadas pelas elipses tracejadas, e irregularidades na superfície. Nas análises de MEV (Figuras 6Be e 6Bf), nota-se o deslocamento da fibra para a superfície do biocompósito além de espaços vazios entre a fibra e a matriz, sugerindo um efeito de segregação de frações da fibra.29 Na Figura 6Bb é apresentada a região de fratura após o ensaio mecânico, em que se constata o rompimento da matriz com o deslocamento da fibra. Especificamente, na região de fratura indicada nas Figuras 6Bg e 6Bh, observa-se um descolamento durante o rompimento com maior magnificação, indicando tal efeito de segregação, destacado por setas nas respectivas imagens. Na amostra ATP/FE75 (Figuras 6Ca-6Ch), também são visíveis regiões com superfícies irregulares, indicando uma segregação parcial da fibra na matriz, como evidenciado por relevos fora do plano da superfície da amostra (indicado por setas). No entanto, esse efeito foi menor quando comparado a amostra ATP/FE250, notando ausência dos poros das fibras na superfície (Figuras 6Ce e 6Cf), indicadas por elipses, o que comprova a melhor adesão do reforço à matriz. Também se constata similar comportamento nas imagens de fratura, conforme observado nas Figuras 6Cg e 6Ch. Embora as partículas de granulometria menor apresentem uma maior área superficial específica, o que aumentaria o contato com a matriz, dois efeitos contrários podem ocorrer durante a mistura e processamento do biocompósito. O primeiro está relacionado com a formação de aglomerados de fibras, de maneira que as fibras não estejam distribuídas homogeneamente na matriz, resultando em pontos de tensão no compósito, o que prejudica a adesão interfacial.50 Assim, fibras mais finas requerem uma combinação e distribuição mais adequada para garantir uma interação satisfatória com a matriz. O outro efeito é a segregação de fibras para superfície do compósito gerando pontos de defeitos e falhas que podem impactar nas propriedades finais dos materiais. Em todos os biocompósitos analisados, as fraturas não ocorreram nas fibras, indicando que o tamanho destas é menor que o comprimento mínimo que poderia promover a fratura nas região das fibras.51 Portanto, fibras de maior tamanho (ATP/FE600), de acordo com as imagens de microscopia, apresentaram uma melhor incorporação e distribuição mais homogênea na matriz ATP, o que resulta em uma melhor adesão a matriz do biocompósito. Para as fibras de menor granulometria, os pontos de aglomeração e processo de segregação prejudicaram a adesão com o ATP.26,51 O processo de dispersão na matriz e a agregação discutida para as amostras de menor granulometria estão esquematicamente representadas na Figura 7.
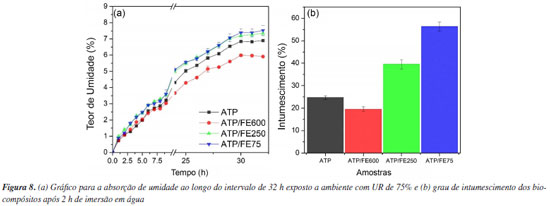
Absorção de umidade e intumescimento O perfil de absorção de umidade das amostras em função do tempo é apresentado na Figura 8a. Já a estabilidade dimensional do biocompósito pode ser avaliada pela determinação do grau de intumescimento durante o contato direto com a água. A Figura 8b mostra os resultados obtidos por meio da análise da espessura após o intervalo de 2 h.
Quando observados os testes, o biocompósito ATP/FE600 absorveu apenas 5,91% de umidade e registrou o menor aumento em sua espessura (19,54%). Esses valores são, inclusive, inferiores aos obtidos para a amostra de ATP puro (sem fibras), que absorveu 6,91% de umidade e 24,74% de água. Em contrapartida, a comparação entre os biocompósitos ATP/FE75 e ATP/FE250 não apresentou diferença significativa para os valores de absorção de umidade, com diferença significativa apenas no valor de intumescimento (56,33 e 39,52%, respectivamente). De forma geral, observa-se comportamento semelhante, em questão de tendência entre as amostras, seja para absorção de umidade seja para o intumescimento. Sabe-se que quanto menor é o tamanho das fibras, maior é sua área superficial específica. Isso resulta em uma maior exposição das hidroxilas presentes na celulose, o que aumenta a sua interação com a água por meio da formação de ligações de hidrogênio. Por este motivo, a tendência de aumento de absorção de umidade/água dos biocompósitos foi inversamente proporcional a granulometria das fibras.27 Além disso, conforme discutido na microscopia ótica e MEV, as amostras ATP/FE75 e ATP/FE250 exibiram maiores irregularidades e falhas em sua superfície, indicando uma menor adesão entre a fibra e a matriz, o que favorece a absorção e incorporação de água no corpo de prova, seja na fase vapor (umidade) ou na fase líquida. Para a amostra ATP/FE600, que apresentou melhor adesão conforme discutido para os ensaios mecânicos e análises de microscopias, tem-se valores inferiores de absorção de umidade e intumescimento. Assim, os resultados indicam que uma adesão mais efetiva corrobora para o aumento da interação presente na interface matriz-fibra por meio de ligações de hidrogênio, diminuindo a quantidade de hidroxilas expostas e disponíveis para absorver umidade/água.28,50
CONCLUSÕES Os biocompósitos foram preparados por meio da técnica de termocompressão, utilizando concentração fixa de fibras de eucalipto, com variação em sua granulometria. Esta pesquisa investigou os comportamentos quanto ao ensaio de tração, análise da morfologia e de absorção de umidade/água desses materiais. Os resultados revelaram que a adição de fibras provocou alterações nas propriedades em comparação com o amido termoplástico puro. Notavelmente, o biocompósito ATP/FE600 demonstrou aumento de 30% na resistência à tração, 63% no módulo elástico e uma redução de 27% no alongamento em relação ao biopolímero de ATP sem reforço. Além disso, observou-se uma leve diminuição no grau de intumescimento e na absorção de umidade quando comparado ao comportamento da matriz, com valores reduzindo de 24 para 19%, e de 6,9 para 5,9%, respectivamente. Por outro lado, as amostras ATP/FE250 e ATP/FE75 apresentaram valores de absorção de umidade e grau de intumescimento mais elevados, o que pode ser atribuído à presença de falhas e irregularidades na superfície do material. Além disso, os resultados apresentados indicaram que para as duas amostras de menor granulometria ocorreu uma menor adesão entre a matriz e as fibras, sendo associado a um efeito de formação de pequenos aglomerados de fibras, efeito mais evidente para a amostra de ATP/FE250 do que a amostra de ATP/FE75. O estudo apresenta o amido como uma alternativa sustentável aos termoplásticos e demonstra o potencial da fibra da casca de eucalipto como aditivo de reforço. Os dados evidenciam que o controle do tamanho das fibras afeta significativamente as propriedades mecânicas e a estabilidade à umidade do biocompósito. Portanto, as dimensões das fibras são um parâmetro crucial a ser controlado na preparação do termoplástico sustentável proposto.
MATERIAL SUPLEMENTAR As imagens dos espectros e outros sistemas utilizados neste trabalho estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS O presente trabalho foi realizado com o apoio financeiro da Fundação de Amparo à Pesquisa e Inovação do Espírito Santo (TO: 938/2022 e processo 2021-Q5DC4). Os autores também agradecem ao Laboratório Multiusuário de Instrumentação - LabMInst (LabPetro-UFES, Brasil) pela realização das análises de espectroscopia FTIR (apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior Brasil (CAPES), código de financiamento 001), ao Laboratório de Materiais Carbonosos - LMC (LabPetro-UFES, Brasil) pela realização das análises de difração de raio-X (DRX) (termo de Cooperação No. 1050.0022844.06.4) e ao Laboratório Luccar/Ufes pela realização das imagens de MEV.
REFERÊNCIAS 1. Jayarathna, S.; Andersson, M.; Andersson, R.; Polymers 2022, 14, 4557. [Crossref] 2. United Nations Environment Programme, From Pollution to Solution: A Global Assessment of Marine Litter and Plastic Pollution, https://www.unep.org/interactive/pollution-to-solution/, acessado em Outubro 2024. 3. Organisation for Economic Cooperation and Development (OECD); Global Plastics Outlook: Economic Drivers, Environmental Impacts and Policy Options; OECD Publishing: Paris, 2022. [Crossref] 4. Yee, M. S.; Hii, L.; Looi, C. K.; Lim, W.; Wong, S.; Kok, Y.; Tan, B.; Wong, C.; Leong, C.; Nanomaterials 2021, 11, 496. [Crossref] 5. Organização das Nações Unidas (ONU), Sobre o Nosso Trabalho para Alcançar os Objetivos de Desenvolvimento Sustentável no Brasil, https://brasil.un.org/pt-br/sdgs, acessado em Outubro 2024. 6. European Commission, Restrictions on Certain Single-Use Plastics, https://environment.ec.europa.eu/topics/plastics/single-use-plastics/eu-restrictions-certain-single-use-plastics_en, acessado em Outubro 2024. 7. Rivadeneira-Velasco, K. E.; Utreras-Silva, C. A.; Díaz-Barrios, A.; Sommer-Márquez, A. E.; Tafur, J. P.; Michell, R. M.; Polymers 2021, 13, 3227. [Crossref] 8. Bangar, S. P.; Whiteside, W. S.; Ashogbon, A. O.; Kumar, M.; Food Packag. Shelf Life 2021, 30, 100743. [Crossref] 9. Cantaño, F. A.; Moreno-Serna, V.; Cament, A.; Loyo, C.; Yáñez, S. M.; Ortiz, J. A.; Zapata, P. A.; Int. J. Biol. Macromol. 2023, 248, 125939. [Crossref] 10. Khan, B.; Niazi, M. B. K.; Ghufrana, S.; Jahan, Zaib.; J. Food Process Eng. 2017, 40, 12447. [Crossref] 11. Behera, A. K.; Mohanty, C.; Pradhan, S.; Das, N.; J. Polym. Environ. 2021, 29, 1031. [Crossref] 12. Fazeli, M.; Keley, M.; Biazar, E.; Int. J. Biol. Macromol. 2018, 116, 272. [Crossref] 13. Chen, J.; Wang, X.; Long, Z.; Wang, S.; Zhang, J.; Wang, L.; Int. J. Biol. Macromol. 2020, 165, 2295. [Crossref] 14. Díaz-Calderón, P.; Simone, E.; Tyler, A. I. I.; Enrione, J.; Foster, T.; Carbohydr. Polym. 2022, 288, 119361. [Crossref] 15. Diyana, Z. N.; Jumaidin, R.; Selamat, M. Z.; Suan, M. S. M.; Hazrati, K. Z.; Yusof, F. A. M.; Ilyas, R. A.; Eldin, S. M.; J. Polym. Environ. 2023, 32, 1406. [Crossref] 16. Ghanbari, A.; Tabarsa, T.; Ashori, A.; Shakeri, A.; Mashkour, M.; Int. J. Biol. Macromol. 2018, 112, 442. [Crossref] 17. Jumaidin, R.; Diah, N. A.; Ilyas, R. A.; Alamjuri, R. H.; Yusof, F. A. M.; Polymers 2021, 13, 1420. [Crossref] 18. Kamaruddin, Z. H.; Jumaidin, R.; Kamaruddin, Z. H.; Asyraf, M. R. M.; Razman, M. R.; Khan, T.; Polymers 2023, 15, 2364. [Crossref] 19. Liu, Y.; Liao, L.; Xiong, J.; Liang, Z.; Polym. Compos. 2022, 43, 2022. [Crossref] 20. Mousa, S. A.; Sapuan, S. M.; Harussani, M. M.; Jamal, T.; Azri, M. A. M.; Ilyas, R. A.; Azman, M. A.; Siddiqui, V. U.; Rafin, T.; J. Nat. Fibers 2023, 20, 2259103. [Crossref] 21. Venegas, R.; Torres, A.; Rueda, A. M.; Morales, M. A.; Arias, M. J.; Porras, A.; Polymers 2022, 14, 748. [Crossref] 22. Indústria Brasileira de Árvores (IBÁ); Relatório Anual 2023; IBÁ: Brasília, 2023. [Link] acessado em Outubro 2024 23. Ministério da Agricultura, Pecuária e Abastecimento (MAPA); Projeções do Agronegócio de 2021/22 a 2031/32, 13a ed.; MAPA: Brasília, 2022. [Link] acessado em Outubro 2024 24. Boukemaoui, A.; Sanchez, C. C.; Engström, J.; Bruce, C.; Fogelström, L.; Carlmark, A.; Malmström, E.; ACS Appl. Mater. Interfaces 2017, 9, 35305. [Crossref] 25. Ben, Z. Y.; Samsudin, H.; Yhaya, M. F.; Eur. Polym. J. 2022, 175, 111377. [Crossref] 26. Castanho, M. N.; Prado, K. S.; Paiva, J. M. F.; Polym. Compos. 2021, 43, 811. [Crossref] 27. Versino, F.; Garcia, M. A.; ACS Sustainable Chem. Eng. 2019, 7, 1052. [Crossref] 28. Santos, B. H.; Prado, K. S.; Jacinto, A. A.; Spinacé, M. A. S.; J. Renewable Mater. 2018, 6, 176. [Crossref] 29. Lomelí-Ramírez, M. G.; Barrios-Guzmán, A. J.; García-Enriquez, S.; Rivera-Prado, J. J.; Manríquez-González, R.; BioResources 2014, 9, 2960. [Link] acessado em Outubro 2024 30. Associação Brasileira de Normas Técnicas (ABNT); NBR NM-ISO3310-1: Peneiras de Ensaio - Requisitos Técnicos e Verificação - Parte I: Peneiras de Ensaio com Tela de Tecido Metálico, 2ª ed.; ABNT: Rio de Janeiro, 2010. 31. Lago, R. C.; Oliveira, A. L. M.; Santos, A. A.; Zitha, E. Z. M.; Carvalho, E. E. N.; Tonoli, G. H. D.; Vilas Boas, E. V. B.; Ind. Crops Prod. 2021, 170, 113816. [Crossref] 32. Kamaruddin, Z. H.; Jumaidin, R.; Ilyas, R. A.; Selamat, M. Z.; Alamjuri, R. H.; Yusof, F. A. M.; Polymers 2022, 14, 2769. [Crossref] 33. Bessa, W.; Trache, D.; Tarchoun, A. F.; Abdelaziz, A.; Hussin, M. H.; Brosse, N.; Sustainability 2023, 15, 3384. [Crossref] 34. Segal, L.; Creely, J. J.; Martin, A. E.; Conrad, C. M.; Text. Res. J. 1959, 29, 786. [Crossref] 35. ASTM D638-22: Standard Test Method for Tensile Properties of Plastics, New York, 2022. 36. ASTM E104-02: Standard Practice for Maintaining Constant Relative Humidity by Means of Aqueous Solutions, New York, 2002. 37. Rasband, W.; ImageJ, version 1.54g; National Institutes of Health, USA, 2015. 38. Pavia, D. L.; Lampman, G. M.; Kriz, G. S.; Vyvyan, J. R.; Introdução à Espectroscopia, 4ª ed.; Cengage Learning: São Paulo, 2015. 39. Nishiyama, Y.; Sugiyama, J.; Chanzy, H.; Langan, P.; J. Am. Chem. Soc. 2003, 125, 14300. [Crossref] 40. Cardoso, M. G. S.; Oliveira, D. N. P. S.; Bufalino, L.; Souza, T. M.; Research, Society and Development 2022, 11, e57311831259. [Crossref] 41. Donald, A. M. Em Encyclopedia of Materials: Science and Technology; Buschow, K. H. J.; Cahn, R.; Flemings, M.; Ilschner, B.; Kramer, E.; Mahajan, S.; Veyssiere, P., eds.; Elsevier: Amsterdam, 2001, p. 7714. [Link] acessado em outubro 2024 42. Nomura, S.: Theoretical and Experimental Studies on the Details of Cellulose Allomorphs; Tese de Doutorado, Graduate School of Chemical Sciences and Engineering, Sapporo, Japan, 2020. [Link] acessado em Outubro 2024 43. Sánchez, M. L.; Patiño, W.; Cárdenas, J.; Journal of Building Engineering 2020, 28, 101058. [Crossref] 44. Abotbina, W.; Sapuan, S. M.; Sultan, M. T. H.; Alkbir, M. F. F.; Ilyas, R. A.; J. Nat. Fibers 2022, 19, 14525. [Crossref] 45. Zarna, C.; Rodríguez-Fabiá, S.; Echtermeyer, A. T.; Chinga-Carrasco, G.; Polymers 2022, 14, 4432. [Crossref] 46. Liu, W.; Drzal, L. T.; Mohanty, A. K.; Misra, M.; Composites, Part B 2007, 38, 352. [Crossref] 47. Mittal, M.; Chaudhary, R.; Mater. Res. Express 2018, 6, 015313. [Crossref] 48. Kim, M. K.; Kim, D. J.; Sens. Actuators, A 2023, 349, 114096. [Crossref] 49. Thomason, J. L.; Vlug, M. A.; Composites, Part A 1996, 27, 477. [Crossref] 50. Lee, C. H.; Khalina, A.; Lee, S. H.; Polymers 2021, 13, 438. [Crossref] 51. Joseph, K.; Medeiros, E. S.; Carvalho, L. H.; Polim.: Cienc. Tecnol. 1999, 9, 136. [Crossref]
Editor Associado responsável pelo artigo: Marcela M. Oliveira |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access