Artigo
|
|
| Bioprospecção de óleos essenciais com potencial para formulações farmacêuticas Bioprospecting of essential oils with potential for pharmaceutical formulations |
|
Emanuelle O. Araújo* Instituto de Ciências Agrárias, Universidade Federal de Minas Gerais, 39404-547 Montes Claros - MG, Brasil Recebido: 13/08/2024 *e-mail: emanuelleagro14@outlook.com Essential oils derived from aromatic plants have garnered significant attention for their therapeutic and medicinal properties. Among these, α-thujone and β-thujone stand out due to their notable biological effects. This study aimed to assess native and exotic aromatic plants as potential sources of these bioactive compounds. Based on the literature, five plant species were selected: Artemisia absinthium (Asteraceae), Hyptis marrubioides (Lamiaceae), Salvia officinalis (Lamiaceae), Tanacetum vulgare (Asteraceae), and Thuja occidentalis (Cupressaceae), resulting in the analysis of 19 samples. The plant leaves were dried, and their essential oils were extracted and evaluated for yield and chemical composition. The oil yields ranged from 0.15 to 1.57%. Gas chromatography-mass spectrometry (GC-MS) analysis identified 82 major volatile constituents, with particular emphasis on α-thujone and β-thujone. Among the species studied, H. marrubioides (62.7%) and T. occidentalis (76.4%) exhibited the highest relative concentrations of α-thujone, while A. absinthium was especially rich in β-thujone (63.91%). Overall, α-thujone and β-thujone were detected in four samples from three species, underscoring their potential as valuable sources of these bioactive compounds. Notably, the native species H. marrubioides demonstrated an essential oil composition comparable to that of T. occidentalis in terms of thujone content, further supporting its viability for industrial and pharmacological applications. INTRODUÇÃO Os óleos essenciais extraídos de plantas medicinais são utilizados desde os tempos mais remotos devido à pluralidade de compostos químicos que os formam e suas possibilidades de aplicação na indústria. No entanto, o conhecimento sobre óleos essenciais está concentrado em aproximadamente 3000 tipos de óleos essenciais, sendo cerca de 300 destacados globalmente.1 O mercado de óleos essenciais foi estimado em 10,3 bilhões de dólares no ano de 2021, tendo nove óleos como principais produtos comercializados.2 O estudo de plantas medicinais e seus óleos essenciais por meio da bioprospecção representa uma ferramenta essencial na condução de estudos abrangentes. Esses estudos buscam identificar, descrever e compreender o potencial de aplicação desses compostos, considerando-os como produtos da interação entre o metabolismo dos organismos e o ambiente em que estão inseridos.3 Thuja occidentalis L. (Cupressaceae), conhecida popularmente como cedro branco ou "árvore da vida", é uma espécie arbórea originária da América do Norte e cultivada no continente europeu e no Brasil, com tamanho médio de 15 m de altura, e bom desenvolvimento em ambientes úmidos, sendo seu óleo essencial amplamente empregado devido à sua composição química.4 A espécie é utilizada pela indústria farmacêutica veterinária como matéria-prima fonte de α-tujona e β-tujona, com ação frente a condilomas e papilomas ocasionados pelo processo de infecção do papilomavirus, podendo acometer humanos e animais.5 Todavia, assim como ocorre com inúmeras espécies, a oferta do óleo essencial no mercado não apresenta fluxo e qualidade contínuas, gerando entraves no processo industrial. Diante do exposto, com o presente estudo, objetivou-se a identificação de plantas aromáticas, nativas ou naturalizadas, com óleos essenciais com potencial para a presença de α-tujona e β-tujona que possam ser utilizadas como matéria-prima na produção de formulações farmacêuticas.
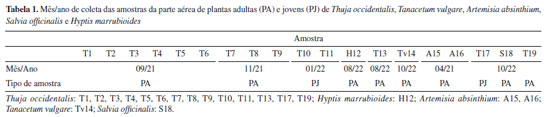
PARTE EXPERIMENTAL Seleção e obtenção do material vegetal Foram selecionadas espécies vegetais que contêm os marcadores químicos α-tujona e β-tujona para o presente estudo. Inicialmente, foram utilizadas plantas jovens e adultas de Thuja occidentalis L. (Cupressaceae), por apresentarem teores desses compostos, que atendem aos requisitos da indústria farmacêutica. Adicionalmente, com o objetivo de identificar possíveis fontes alternativas dos compostos em questão, foram analisadas amostras de Artemisia absinthium L. (Asteraceae), Hyptis marrubioides Epling (Lamiaceae) - depósito MCCA 5711, Salvia officinalis L. (Lamiaceae) e Tanacetum vulgare L. (Asteraceae), totalizando 19 amostras, conforme descrito na Tabela 1.
O estudo foi conduzido no Laboratório de Plantas Medicinais do Centro de Pesquisa em Ciências Agrárias do Instituto de Ciências Agrárias da Universidade Federal de Minas Gerais (CPCA-UFMG) (16º41'05"S 43º50'37"W), no período de setembro/2021 a outubro/2022. O projeto foi registrado no SisGen (Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado) sob o número A0AC958, devido ao acesso ao patrimônio genético brasileiro. Extração do óleo essencial As amostras de folhas de todas as cinco espécies de plantas foram secas em estufa a 45 ºC e armazenadas em sacos de polietileno ao abrigo da luz até o momento da extração. O óleo essencial foi extraído das folhas por hidrodestilação, com aparelho tipo Clevenger, durante duas horas.6 Os óleos essenciais extraídos, em razão de sua menor densidade em comparação à água, foram coletados do sistema utilizando uma pipeta de Pasteur, assegurando a completa ausência de traços de água. Após a separação total da fase aquosa, o óleo essencial foi transferido para frascos de vidro âmbar, pesados e armazenados a uma temperatura de -8 ºC. Antes de seu envio para análise, foi realizada a verificação para confirmar a ausência de qualquer contaminação por água. Os óleos essenciais de Thuja occidentalis receberam os códigos T1, T2, T3, T4, T5, T6, T7, T8, T9, T10, T11, T13, T17, T19; Hyptis marrubioides, H12; Artemisia absinthium, A15, A16; Tanacetum vulgare, TV14; Salvia officinalis, S18. O teor de óleo (%) foi calculado com base na matéria seca pela expressão: 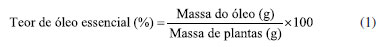 Análise CG-EM e composição química dos óleos essenciais A análise química do óleo essencial foi realizada no Laboratório de Química Instrumental do ICA/UFMG, utilizando cromatografia gasosa acoplada a espectrometria de massas (CG-EM), sendo o analisador do tipo quadrupolo. As amostras foram diluídas em diclorometano (1 mg mL-1), transferidas para vials (2 mL) e analisadas individualmente, em coluna capilar de sílica fundida DB-5 MS (30 m × 0,25 mm × 0,25 μm) e hélio (fluxo 1 mL min-1) como gás de arraste. A programação da temperatura foi de 60 a 240 ºC, com incremento de 3 ºC min-1. O sistema foi operado no modo scan (monitoramento), com impacto eletrônico a 70 eV, em faixa de 45 a 550 (m/z). Foi injetada a série padrão de n-alcanos C7 a C40 (Sigma-Aldrich), nas mesmas condições para o cálculo do índice de retenção (IR). Os dados gerados foram analisados e os compostos identificados com o uso do software MSD ChemStation (E.02.021431 Copyright© 1989-2011, Agilent Technologies, EUA), juntamente com a biblioteca National Institute of Standards and Technology,7 comparados com informações da literatura8 e com o IR do composto. A abundância relativa (%) dos íons totais referentes aos compostos foi calculada, a partir da área de pico do cromatograma e organizada de acordo com a ordem de eluição. O IR calculado foi realizado de acordo com van den Dool e Kratz.9 Análises estatísticas Para análise da composição química do óleo essencial foi empregada a análise multivariada, com o auxílio da plataforma estatística MetaboAnalistyR 5.0.10 Devido à heterogeneidade das amostras, os resultados foram submetidos à análise de componentes principais (ACP) e de agrupamentos hierárquicos (AAH), com base na distância euclidiana.
RESULTADOS E DISCUSSÃO Rendimento e composição química dos óleos essenciais O processo de hidrodestilação das folhas das dezenove amostras avaliadas resultou em óleos essenciais com coloração variável, desde translúcido até amarelado (Figura 1).

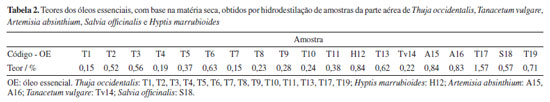
Os teores dos óleos obtidos apresentaram variação de 0,15 a 1,57%, conforme descrito na Tabela 2. O maior teor 1,57% foi obtido na amostra T. occidentalis (T17), enquanto o menor teor 0,15% foi obtido em amostra de T. occidentalis (T1 e T7), indicando variabilidade no teor de óleos essenciais para a espécie pertencente à família Cupressaceae. A mesma variação foi observada nas famílias Asteraceae (T. vulgare e A. absinthium), teores de 0,22 à 0,84%, e Lamiaceae (H. marrubioides e S. officinalis) com teores de 0,84 e 0,57%, respectivamente.
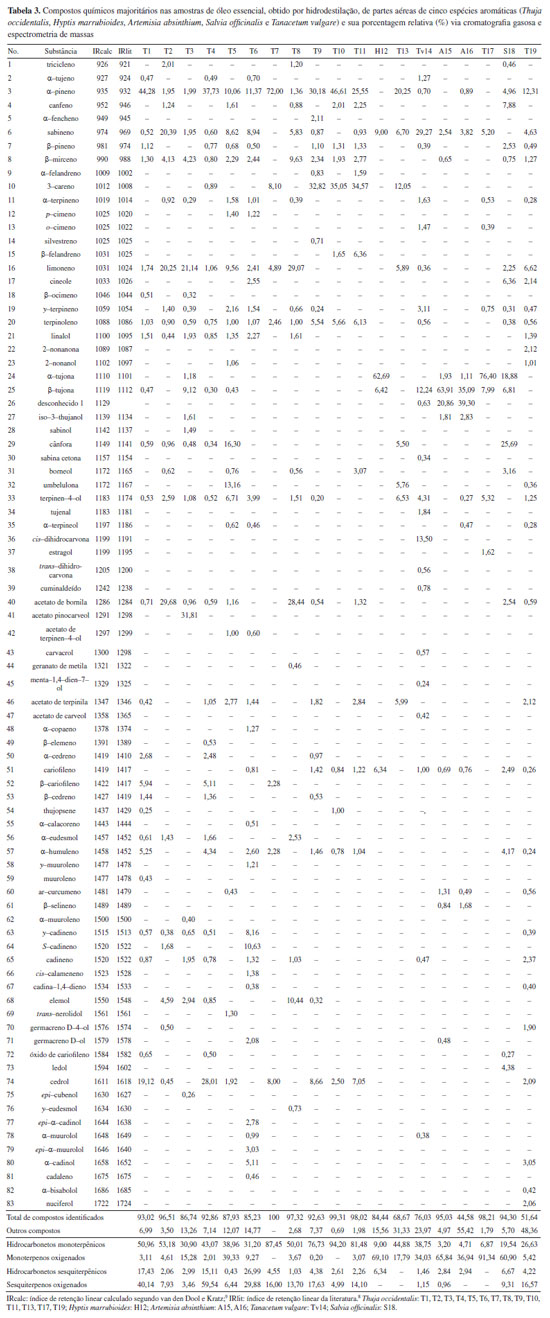
O conteúdo de óleos essenciais presentes nas plantas é influenciado por múltiplos fatores como idade da planta, aspectos nutricionais, modo de coleta, secagem/armazenamento, ataque de patógenos, condições climáticas etc. Assim, os teores podem sofrer variações em espécies distintas ou dentro de uma mesma população.11 A quantificação do teor de óleo em espécies medicinais permite seu emprego como matéria-prima e possibilidade de avançar em etapas posteriores à bioprospecção, espécies com maiores rendimentos são preferencialmente empregadas. A análise da composição química, dos óleos essenciais obtidos das amostras avaliadas, possibilitou a identificação de 82 compostos (Tabela 3). De forma geral, os constituintes presentes nos óleos pertencem à classe dos terpenos, com prevalência de hidrocarbonetos monoterpênicos (3,20-94,20%) e monoterpenos oxigenados (0,20-91,34%), hidrocarbonetos sesquiterpênicos (0,43-26,99%) e sesquiterpenos oxigenados (0,96-59,54%). Os compostos identificados com maior abundância nas amostras foram α-tujona, β-tujona, α-pineno, sabineno, 3-careno, limoneno, cânfora, acetato de bornila, acetato de trans-pinocarvil, conforme demostrado na Tabela 3.
Compostos majoritários e suas aplicabilidades Marcadores α-tujona e β-tujona As amostras de H. marrubioides (H12) e T. occidentalis (T17) apresentaram as maiores abundâncias dos compostos α-tujona, 62,7 e 76,4% respectivamente, enquanto as amostras de A. absinthium (A15 e A16) apresentaram maior conteúdo de β-tujona, com percentuais de 63,91 e 35,09%, respectivamente, como apresentado na Tabela 3. Os compostos α-tujona e β-tujona são classificados como cetonas monoterpênicas, presentes de forma natural nos óleos essenciais de várias espécies. Esses óleos podem ser utilizados tanto para fins alimentícios quanto medicinais.12 Os produtos derivados das partes aéreas de T. occidentalis que contêm tujona, como extratos, tinturas-mãe e medicamentos, têm sido empregados na medicina tradicional e na homeopatia. Estudos têm evidenciado seu potencial imunofarmacológico por meio de testes in vitro e in vivo, demonstrando atividades imunoestimulantes e antivirais,4 especialmente contra infecções do trato respiratório e no tratamento de resfriados comuns.13 Além disso, os efeitos bioativos dos extratos de T. occidentalis também são documentados, sugerindo que os compostos químicos presentes na planta podem agir em sinergia para promover seus efeitos.14 Ademais, esses preparados ganham destaque por sua aplicação também no tratamento de condilomas e papilomas, conhecidos popularmente como "verrugas", no geral associadas à infecção ocasionada pelo papilomavirus, podendo acometer humanos e animais.5 Na veterinária, sua utilização foi relatada no tratamento de papilomatose canina com a administração do medicamento homeopático 12CH, com eliminação total da massa verrugosa, mostrando ser uma alternativa eficiente, rápida e com valor econômico bem acessível.15 Em bovinos, a aplicação de tratamentos de 10 mL de preparados homeopáticos 6CH por 63 dias promoveram a redução das verrugas em 20% dos animais e regressão parcial em 80% nos demais, com alterações macroscópicas de coloração e tamanho das verrugas confirmado pelo exame histopatológico.16 Em aves, devido às propriedades imunoestimulantes e antivirais, os extratos vêm sendo recomendados e utilizados, de maneira empírica, por criadores e veterinários para o tratamento das poxviroses aviárias.17 Demais compostos majoritários detectados As amostras de T. occidentalis (T1, T4, T6, T7, T10, T13 e T19), apresentaram α-pineno como composto de maior abundância em seus óleos essenciais. Esse monoterpeno está amplamente distribuído em diversas plantas produtoras de óleos essenciais, tornando-os de grande interesse econômico por suas aplicabilidades e usos, como fungicidas, alimentos, perfumaria, antivirais e antimicrobianos.18 Na indústria alimentícia e na perfumaria, devido, entre outros fatores, ao aroma de pinheiro fresco e ao sabor amadeirado.19 Além disso, apresenta diversas atividades com estudos pré-clínicos frente a inúmeros distúrbios e patógenos, sendo relacionadas as atividades antimicrobianas, anticoagulante, anti-inflamatória, antitumoral, antioxidante, gastro e neuroprotetora.20 A amostra Tv14 de T. vulgare apresentou como composto majoritário o sabineno. Este monoterpeno bicíclico apresenta inúmeras aplicabilidades, como na indústria de perfumes, produtos químicos, aromatizantes alimentícios e potencial uso como biocombustível, sendo encontrado nos óleos essenciais de várias espécies,21 não existindo, até o presente momento, metodologias que permitam sua síntese de forma comercial.22 O composto 3-careno apresentou maior abundância nas amostras de T. occidentalis T9 e T11. Este composto é classificado como monoterpeno, presente em diversas espécies, sendo sua ação antimicrobiana relatada frente a patógenos presentes em produtos de origem alimentícia. A aplicação da solução do composto evidenciou que o 3-carene pode atrasar o crescimento de bactérias e até mesmo levar à morte celular.23 O limoneno foi o composto de maior abundância na amostra T8 de T. occidentalis. A presença desse composto é relatada principalmente nos óleos essenciais extraídos dos citrus, como laranja, tangerina, limão e ainda nas uvas.24 É comumente empregado na indústria de cosméticos, alimentícia e de perfumes, apresentando odor semelhante ao limão e aspecto incolor.25 As amostras de T. occidentalis T5 e de S. officinalis S18, apresentaram como composto majoritário a cânfora. Este componente de óleos essenciais possui diversas aplicações, sendo relatadas seu emprego em medicamentos tradicionais e modernos, podendo ser usado de forma isolada ou em conjunto com outros tratamentos. De forma tradicional, é aplicada no tratamento de resfriado comum e em inflamações diversas, tendo como via de aplicação tópica, na forma de injeções, inalações e ingestão.26 A amostra de T. occidentalis (T2) apresentou o acetato de bornila em maior abundância, este composto é comumente detectado como constituinte principal dos óleos essenciais extraídos de espécies de coníferas, sendo aplicado por seus efeitos antioxidantes e anti-inflamatórios.27 Além disso, a presença desse composto em T. occidentalis demonstrou sua utilização como um potente agente antimicrobiano frente à podridão do mofo cinzento, com 9,31% de abundância desse composto no óleo analisado,28 evidenciando o potencial de utilização de óleos que contenham esse composto como biopesticidas.29 A amostra de T. occidentalis (T3) apresentou como composto majoritário o acetato de pinocarveol. Para esse composto, não foram encontrados na literatura até o presente momento uma descrição de sua ação medicinal ou de suas aplicações potenciais de forma isolada, no entanto, um estudo de caracterização do óleo de Eryngium caeruleum M. Bieb. (Apiaceae), tendo este como composto em níveis elevados, apresenta comprovada atividade bacteriana.30 Análises de agrupamento hierárquico (AAH) e de componentes principais (ACP) A partir da análise de agrupamento, observou-se separação das amostras em quatro grupos, sendo o grupo I constituído pelas amostras 1, 4, 7, 9, 10, 11 (T. occidentalis: T1, T4, T7, T9, T10, T11, respectivamente) as mais diferentes, o grupo II constituído pelas amostras 12 e 17 (H. marrubioides: H12 e T. occidentalis: T10), posteriormente, o grupo III formado pelas amostras 15 e 16 (A. absinthium: A15 e A16). As demais amostras 2, 3, 5, 6, 8, 13, 14, 18, 19 (T. occidentalis: T2, T3, T5, T6, T8, T13, T19; T. vulgare: Tv14; S. officinalis: S18) apresentaram maior similaridade química entre si, compondo o grupo IV (Figura 2).

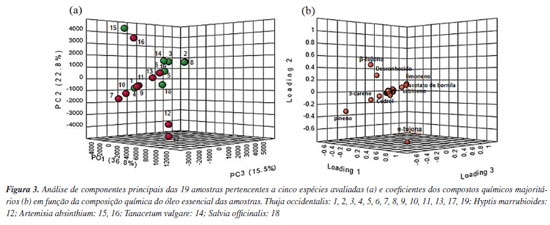
Para a análise de componentes principais, um modelo de ACP de três componentes expressou 75,1% da variância total, sendo o primeiro componente principal (PC1) responsável por 36,8%, o segundo componente principal (PC2) por 22,8% e, o terceiro componente principal (PC3), por 15,5% da variância total, possibilitando determinar a distribuição das amostras e os compostos que mais influenciaram o conjunto de dados (Figura 3). No gráfico 3D confeccionado é possível observar a distribuição das amostras semelhante ao observado na análise de agrupamento hierárquico, confirmando a formação de quatro grupos distintos.
Assim, o PC1 correlacionou-se positivamente com a α-tujona, sendo este o composto majoritário encontrado nas amostras 12 e 17, que correspondem às espécies H. marrubioides Epling, Tiradentes/MG (H12) e T. occidentalis, Pouso Alegre/MG (T17), correspondendo ao grupo II, evidenciando assim a similaridade existente entre os óleos essenciais dessas duas espécies. A PC2 correlacionou-se positivamente com β-tujona, encontrado em maior proporção relativa nas amostras 15 e 16, grupo III, que correspondem às amostras de losna (Artemisia absinthium L.: A15 e A16) avaliadas neste estudo. Além da presença desse composto, o perfil químico dessas amostras é semelhante. Ademais, vale ressaltar que a análise cromatográfica apresentada na Tabela 3 apresentou um composto com teor superior ao β-tujona, com 39,30% (composto No. 26) com índice de retenção calculado de 1129. Esse foi o único composto no qual não foi possível a sua identificação dentre os 83 ativos químicos presentes nas 19 amostras de óleos analisadas. A PC3 correlacionou-se positivamente com os compostos limoneno, acetato de bornila e sabineno sendo que esse grupo é compostos por três espécies, Salvia officinalis L. (S18), Tanacetum vulgare L. (Tv14) e T. occidentalis (T2 e T8). Essa correlação foi positiva para T2 e T8, onde os três compostos foram os majoritários, em que o limoneno apresentou, em T8, 29,07% e, em T2, 20,25%; o acetato de bornila apresentou, em T2, 29,68% e, em T8, 28,44%; e o sabineno apresentou em T2 20,39% e T8 5,83%, respectivamente. Enquanto que para TV14 houve relação positiva direta com o sabineno, seu composto majoritário (29,27%); o limoneno apresentou 0,36% e o acetado de bornila foi ausente na amostra dessa espécie. O conteúdo dos compostos α-tujona e β-tujona, selecionados como marcadores do presente estudo apresentou variação entre as amostras. A variação química identificada nas análises dos óleos essenciais pode ser explicada por diversos fatores, como avaliação de espécies diferentes, plantas em estádios de desenvolvimento distintos, local de coleta e, ou, obtenção das amostras, época de coleta, possível presença de quimiotipos.31 Németh e Nguyen31 apresentaram um levantamento sobre a tujona para quatro espécies que também compõe esse estudo (Artemisia absinthium,Salvia officinalis,Tanacetum vulgare, Thuja occidentalis), e evidenciaram a ocorrência de variabilidade química, intra e interespecífica, podendo haver oscilações no conteúdo de tujona, e ainda quanto à sua presença nos óleos essenciais. Ademais, os autores sugerem que a tujona poderia ser um marcador quimiotaxonômico. Quanto à T. occidentallis, os autores relatam que a tujona é o composto dominante do gênero Thuja sp. e que de maneira geral ainda não haviam sido relatados estudos em que o composto não foi detectado, como observado no presente estudo, onde foram registradas amostras totalmente livres de tujonas ou com níveis não detectáveis. Portanto, a realização de estudos que elucidem a composição química de diferentes espécies em mesmas condições de análises se faz cada vez mais necessários, possibilitando a comparação e indicação das potencialidades das espécies e seus óleos essenciais. Além disso, estudos de espécies locais e, ou, do comportamento de espécies com potencial econômico e farmacológico, permitem o desenvolvimento de manejos eficientes e a exploração de novos mercados.
CONCLUSÃO Os compostos α-tujona e β-tujona foram identificados em seis amostras, de quatro espécies, sendo elas Thuja occidentalis,Artemisia absinthium, Hyptis marrubioides (H12) e Salvia officinalis L. (S18) possibilitando a utilização dessas espécies como fonte desses compostos. Hyptis marrubioides foi a espécie cujo óleo essencial foi mais similar ao de Thuja occidentalis, considerando os níveis de tujona nas duas formas isoméricas requeridas pela indústria. Todavia, além da composição química, é necessária a realização de estudos que elucidem o comportamento das espécies em sistema de cultivo, para a região norte-mineira, viabilizando sua utilização como fontes de α-tujona e β-tujona, alternativas à Thuja occidentalis e Artemisia absinthium. Outros compostos majoritários, também identificados nesse estudo, tornam possível a exploração das espécies como fonte alternativa desses compostos para aplicação industrial nas diferentes áreas como a farmacêutica, de fragrâncias, alimentícia, dentre outras.
AGRADECIMENTOS Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), à Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) pela concessão de bolsas que permitiram a dedicação integral à pesquisa e ainda pelo financiamento e suporte que possibilitaram a realização deste projeto. Agradecemos ainda à VetBras-Saúde e Nutrição Animal pela parceria com o Instituto de Ciências Agrárias (UFMG). O apoio financeiro e a expertise fornecidos foram fundamentais para o desenvolvimento deste projeto, enriquecendo a pesquisa e promovendo a troca de conhecimentos.
REFERÊNCIAS 1. Bakkali, F.; Averbeck, S.; Averbeck, D.; Idaomar, M.; Food Chem. Toxicol. 2008, 46, 446. [Crossref] 2. Bizzo, H. R.; Rezende, C. M.; Quim. Nova 2022, 45, 949. [Crossref] 3. Berlinck, R. G. S.; Cienc. Cult. 2012, 64, 27. [Crossref] 4. Naser, B.; Bodinet, C.; Tegtmeier, M.; Lindequist, U.; Evidence-Based Complementary and Alternative Medicine 2005, 2, 69. [Crossref] 5. Fernandes, M. C.; Ribeiro, M. G.; Fedato, F. P.; Paes, A. C.; Megid, J.; Semina: Cienc. Agrar. 2009, 30, 215. [Link] acessado em Março 2025 6. Ming, L. C.; Figueiredo, R. O.; Machado, S. R.; Andrade, R. M. C.; Acta Hortic. 1996, 426, 555. [Crossref] 7. National Institute of Standards and Technology (NIST); PC version of the NIST/EPA/NIH Mass Spectral Database; NIST, EUA, 2009. 8. Adams, R. P.; Identificação de Componentes de Óleos Essenciais por Cromatografia Gasosa/Espectroscopia de Massas, 4ª ed.; Allured Publ. Corp: Carol Stream, IL, EUA, 2017. 9. van den Dool, H.; Kratz, P. D.; J. Chromatogr. A 1963, 11, 463. [Crossref] 10. Pang, Z.; Chong, J.; Li, S.; Xia, J.; Metabolites 2020, 10, 186. [Crossref] 11. Gobbo-Neto, L.; Lopes, N. P.; Quim. Nova 2007, 30, 374. [Crossref] 12. Pelkonen, O.; Abass, K.; Wiesner, J.; Regul. Toxicol. Pharmacol. 2013, 65, 100. [Crossref] 13. Alves, L. D. S.: Thuja occidentalis Linn (Cupressaceae): da Droga Vegetal a Forma Farmacêutica Semissólida para o Tratamento do HPV; Tese de Doutorado, Universidade Federal de Pernambuco, Recife, 2014. [Link] acessado em Março 2025 14. Caruntu, S.; Ciceu, A.; Olah, N. K.; Don, I.; Hermenean, A.; Cotoraci, C.; Molecules 2020, 25, 5416. [Crossref] 15. Queiroz, F. F.; Rodrigues, A. B. F.; Di Filippo, P. A.; Almeida, A. J.; Silveira, L. S.; Rev. Bras. Plant. Med. 2015, 17, 945. [Crossref] 16. Monteiro, V. L. C.: Uso da Thuya occidentalis no Tratamento da Papilomatose Bovina: Aspectos Clínicos, Histopatológicos e Moleculares; Tese de Doutorado, Universidade Federal Rural de Pernambuco, Recife, 2007. [Link] acessado em Março 2025 17. Chaves, T. C. B.; Bernardo, A. R.; Sanavria, A.; Brito, M. F.; da Cruz, G. B.; Danelli, M. G. M.; Mazur, C.; Cienc. Rural 2006, 36, 1334. [Crossref] 18. Allenspach, M.; Steuer, C.; Phytochemistry 2021, 190, 112857. [Crossref] 19. Vespermann, K. A. C.; Paulino, B. N.; Barcelos, M. C. S.; Pessôa, M. G.; Pastore, G. M.; Molina, G.; Appl. Microbiol. Biotechnol. 2017, 101, 1805. [Crossref] 20. Salehi, B.; Upadhyay, S.; Orhan, I. E.; Jugran, A. K.; Jayaweera, S. L. D.; Dias, D. A.; Sharopov, F.; Taheri, Y.; Martins, N.; Baghalpour, N.; Cho, W. C.; Sharifi-Rad, J.; Biomolecules 2019, 9, 738. [Crossref] 21. Rossi, P.-G.; Berti, L.; Panighi, J.; Luciani, A.; Maury, J.; Muselli, A.; Serra, D. R.; Gonny, M.; Bolla, J.-M.; J. Essent. Oil Res. 2007, 19, 176. [Crossref] 22. Cao, Y.; Zhang, H.; Liu, H.; Liu, W.; Zhang, R.; Xian, M.; Liu, H. N.; Appl. Microbiol. Biotechnol. 2018, 102, 1535. [Crossref] 23. Shu, H.; Chen, H.; Wang, X.; Hu, Y.; Yun, Y.; Zhong, Q.; Chen, W.; Chen, W.; Molecules 2019, 24, 3246. [Crossref] 24. González-Mas, M. C.; Rambla, J. L.; López-Gresa, M. P.; Blázquez, M. A.; Granell, A.; Front. Plant Sci. 2019, 10, 12. [Crossref] 25. Anandakumar, P.; Kamaraj, S.; Vanitha, M. K.; J. Food Biochem. 2021, 45, e13566. [Crossref] 26. Hamidpour, R.; Hamidpour, S.; Hamidpour, M.; Shahlari, M.; International Journal of Case Reports and Images 2013, 4, 86. [Crossref] 27. Yang, L.; Liu, J.; Li, Y.; Qi, G.; Biomed. Pharmacother. 2018, 103, 234. [Crossref] 28. Yong, S. H.; Song, H. J.; Park, D. J.; Kim, D. H.; Park, K. B.; Choi, M. S.; Forest Science and Technology 2021, 17, 169. [Crossref] 29. Song, H.-J.; Yong, S.-H.; Kim, H.-G.; Kim, D.-H.; Park, K.-B.; Shin, K.-C.; Choi, M.-S.; Horticulturae 2022, 8, 969. [Crossref] 30. Konovalov, D. A.; Cáceres, E. A.; Shcherbakova, E. A.; Herrera-Bravo, J.; Chandran, D.; Martorell, M.; Hasan, M.; Kumar, M.; Bakrim, S.; Bouyahya, A.; Cho, W. C.; Sharifi-Rad, J.; Suleria, H. A. R.; Calina, D.; Chin. Med. 2022, 17, 114. [Crossref] 31. Németh, É. Z.; Nguyen, H. T.; Phytochem. Rev. 2020, 19, 405. [Crossref]
Editor responsável pelo artigo: Jorge M. David |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access