Revisão
|
|
| Constituintes químicos e atividades biológicas de Remijia DC. (Rubiaceae): uma revisão Chemical constituents and biological activities of Remijia DC. (Rubiaceae): a review |
|
Fábio G. de Souza; Gabriel S. Crispim; Luana da C. Moreira; Cecilia V. Nunez* Coordenação de Tecnologia e Inovação, Instituto Nacional de Pesquisas da Amazônia, 69067-375 Manaus - AM, Brasil Recebido: 10/11/2024 *e-mail: cecilia@inpa.gov.br Plants of Remijia DC. (Rubiaceae) are widely distributed in South America and are often known by the popular names of "quinas" and "quinas-falsas" because of their similarity to the genus Cinchona L. This study consisted of a review of the reported substances and biological activities found in the Remijia genus. For this purpose, information was collected from SciFinder, ScienceDirect, PubMed and Google Scholar databases by entering the term "Remijia". It was found that only four species have been chemically and biologically studied: R. ferruginea, R. peruviana, R. pedunculata and R. purdieana. Thirty-eight substances of different chemical classes were found, such as: quinoline alkaloids, indole alkaloids, flavonoids, phenolic acids, steroids, and a triterpene. Among the substances produced by these plants, quinoline alkaloids stood out, with 12 substances identified. In addition, the extracts and isolated substances from this genus showed antioxidant, anti-inflammatory activity of TNF-α (tumor necrosis factor alpha) inhibition, antiplasmodial, wound healing, cytotoxic, anti-Trypanosoma, antifeedant, antimalarial, antihyperlipidemic, antihyperglycaemic and ferriprotoporphyrin IX inhibition activities. This review demonstrates the chemical variability found in Remijia species and encourages further chemical studies. The great preference observed by the Remijia species studied to date to produce quinoline and indole alkaloids indicates that they are the chemosystematic markers of the genus. INTRODUÇÃO Remijia DC. é um gênero que compreende 43 espécies de plantas, distribuídas principalmente na América do Sul (Brasil, Bolívia, Colômbia, Equador, Guianas, Peru e Venezuela). Na flora brasileira, estão registradas 25 espécies localizadas na Bacia Amazônica, Mata Atlântica, Cerrado, Caatinga e Campos Rupestres, com uma notável diversidade na região Norte com 23 representantes.1-3 O gênero Remijia pertence à família Rubiaceae, a qual apresenta maior abundância de número de espécies na Amazônia. Trata-se da quarta família com maior número de espécies entre as Angiospermas. Atualmente são aceitas 14.274 espécies e 611 gêneros subdivididos em três subfamílias (Cinchonoideae Raf., Ixoroideae Raf. e Rubioideae Verdc) e 64 tribos.4-7 Em Rubiaceae, cada subfamília apresenta uma quimiossistemática bem definida e específica: Ixoroideae se destaca pelos iridoides e os triterpenos; Rubioideae é a subfamília com maior amplitude de substâncias prevalecendo as antraquinonas, alcaloides, iridoides e triterpenos; e Cinchonoideae se destaca pelos alcaloides indólicos e outros tipos de alcaloides. A família Rubiaceae apresenta uma grande diversidade de alcaloides com várias propriedades farmacológicas, além disso, os alcaloides indólicos são marcadores químicos da família.8,9 Atualmente, Remijia se encontra classificada na subfamília Cinchonoideae e na tribo Cinchoneae DC. No gênero foram encontrados ácidos fenólicos, alcaloides indólicos, alcaloides oxindólicos, alcaloides quinolínicos, flavonoides, esteroides e triterpenos, com atividade antioxidante, citotóxica, anti-Trypanosoma cruzi e efeitos antialimentares associados.10,11 Existem relatos de plantas desse gênero que são usadas tradicionalmente por populações na Amazônia, para o tratamento de sintomas relacionados à malária.12,13 Este estudo tem como objetivo apresentar uma revisão acerca das substâncias isoladas e atividades biológicas relatadas até o momento para o gênero Remijia.
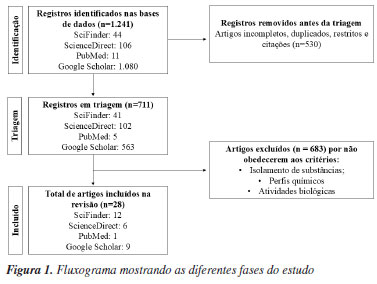
METODOLOGIA Para realizar a busca acerca das substâncias isoladas, perfis químicos e atividades biológicas do gênero Remijia DC. foram utilizadas as bases de dados SciFinder, ScienceDirect, PubMed e Google Scholar para complementar o estudo, inserindo o termo "Remijia". Como critérios de inclusão, foram selecionados apenas estudos com isolamento de substâncias, perfis químicos e atividades biológicas de espécies de Remijia. Foram obtidos 1.241 artigos de pesquisas, livros, dissertações, teses e trabalhos de congressos publicados até outubro de 2024. Foram removidos 530 artigos incompletos, duplicados, restritos e citações e 683 por não obedecerem aos critérios de inclusão, ao final 28 referências foram utilizadas para compor o presente trabalho (Figura 1). As estruturas químicas relatadas foram desenhadas usando o software ChemDraw 18.1 (PerkinElmer, EUA, 2019) com auxílio das bases de dados SciFinder e PubChem.
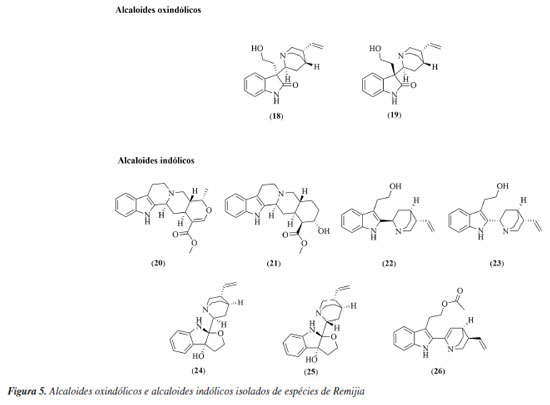
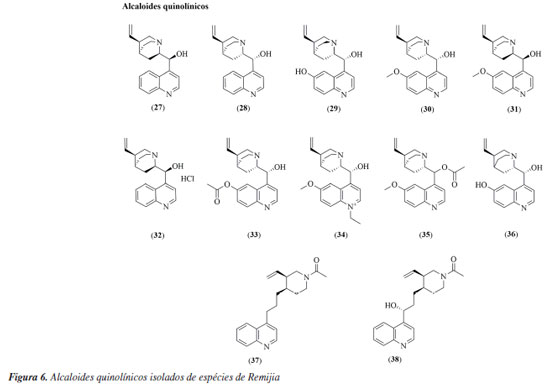
RESULTADOS Pelo levantamento bibliográfico realizado, das 43 espécies de Remijia apenas 4 foram investigadas em estudos químicos e biológicos, sendo elas: Remijia ferruginea (A.st.Hil.) DC., Remijiapedunculata (H.Karst.) Flueck., Remijia peruviana Standl. e Remijia purdieana Wedd. Estas espécies apresentaram diferentes atividades biológicas e foram identificadas/caracterizadas 38 substâncias pertencentes a diversas classes químicas, como mostradas na Tabela 1 e nas Figuras 2 a 6. A seguir estão citados os resultados obtidos para cada uma das espécies estudadas.
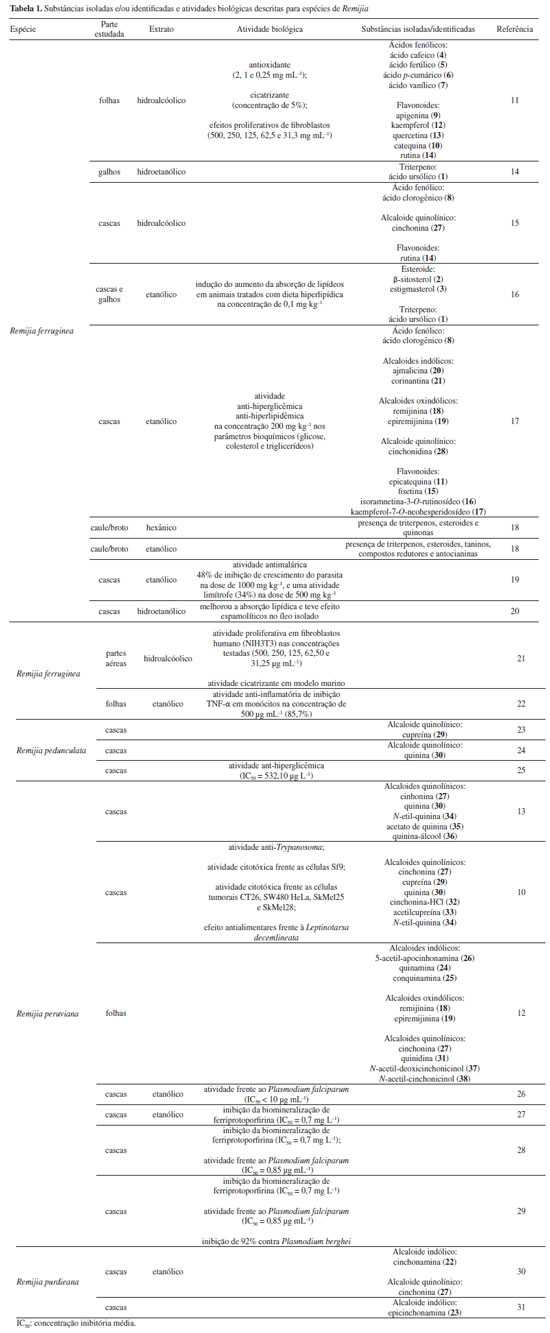
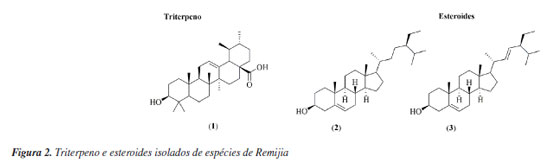
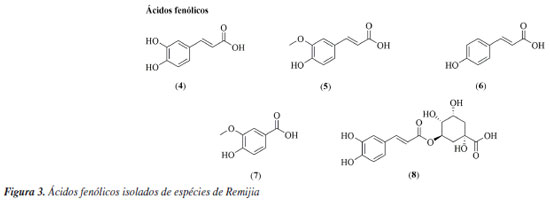
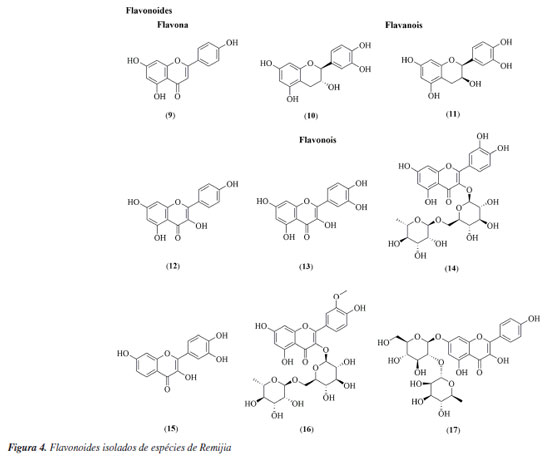
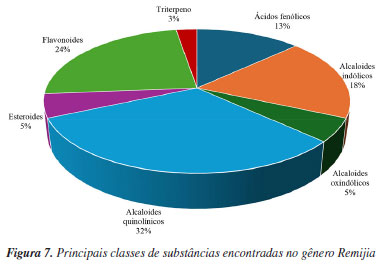
Remijia ferruginea (A.St.-Hil.) DC. Remijia ferruginea (A.St.-Hit.) DC., conhecida popularmente como quina-mineira, quina-de-remijio e entre outros é a espécie mais conhecida do gênero. O fitoterápico brasileiro Ierobina® é constituído dos extratos de Remijia ferruginea (A.St.-Hit) DC., Solanum paniculatum L., Jacaranda caroba (Vell.) DC. e Erythraea centaurium (L.) Borkh. Braga et al.14 analisaram a composição química dos extratos que constituem o fitoterápico Ierobina® e observaram a presença de ácido ursólico (1) no extrato hidroetanólico dos galhos de R. ferruginea. Sarandy et al.11 avaliaram os extratos hidroalcóolicos de folhas e observaram a presença de diversas substâncias fenólicas como ácido cafeico (4), ácido ferúlico (5), ácido p-cumárico (6), ácido vanílico (7), e flavonoides de diferentes classes, como a flavona apigenina (9), flavanois como catequina (10) e rutina (14) e os flavonois kaempferol (12), quercetina (13) e rutina (14). Por sua vez, do extrato hidroalcóolico das cascas foram identificadas a rutina (14), ácido clorogênico (8) e cinchonina (27).15 Valadares16 isolou e caracterizou as seguintes substâncias a partir dos extratos etanólicos de cascas e galhos: ácido ursólico (1), β-sitosterol (2) e estigmasterol (3). Posteriormente, Cosenza et al.17 identificaram no extrato etanólico das cascas a presença das seguintes substâncias: ácido clorogênico (8), epicatequina (11), fisetina (15), isoramnetina-3-O-rutinosídeo (16), kaempferol-7-O-neohesperidosídeo (17), remijinina (18), epiremijinina (19), ajmalicina (20), corinantina (21) e cinchonidina (28). Rodrigues et al.18 analisaram os extratos hexânicos e etanólicos do caule/broto e observaram indícios de terpenos, esteroides e quinonas no extrato hexânico e triterpenos, esteroides, taninos, compostos redutores e antocianinas no extrato etanólico. Em relação à atividade biológica, Sarandy et al.11 analisaram a capacidade antioxidante, cicatrizante e efeitos proliferativos de fibroblastos do extrato hidroalcoólico das folhas de Remijia ferruginea. A análise da capacidade antioxidante foi realizada utilizando a metodologia DPPH (2,2-difenil-1-picril-hidrazila) e apresentou uma alta taxa de sequestro nas concentrações de 2, 1 e 0,25 mg mL-1 quando comparado aos controles (rutina e butil-hidroxitolueno). O ensaio de proliferação de fibroblastos (in vitro) foi realizado em linhagem celular de fibroblastos murinos (NIH3T3) nas concentrações de 500, 250, 125, 62,5 e 31,3 mg mL-1 e os resultados apresentados mostraram maior atividade proliferativa de fibroblastos do que no controle positivo (meio de cultura + células) em todas as concentrações. Os fibroblastos ocasionam um estresse na matriz extracelular estimulando a secreção de proteínas, como o colágeno, auxiliando na contração de feridas. O extrato hidroalcoólico de R. ferruginea estimulou a proliferação de fibroblastos. O teste cicatrizante (in vivo) foi realizado durante 21 dias em modelo murino através de pomadas contendo o extrato hidroalcoólico de R. ferruginea nas concentrações de 1% (1 g), 3% (3 g) e 5% (5 g). Como controle positivo foi usada a pomada Fitoscar® e como controle negativo foi usado o veículo de pomada. As pomadas de R. ferruginea foram avaliadas pela primeira vez para cicatrização e promoveram a maturação do colágeno em feridas e também modularam as defesas antioxidantes endógenas. Os resultados indicaram que as três doses testadas de extrato hidroalcoólico de R. ferruginea (1, 3 e 5%) puderam modular o processo de reparação da pele, e que os melhores efeitos foram observados após a exposição à dose mais alta. Andrade-Neto et al.19 analisaram a atividade antimalárica in vivo do extrato etanólico das cascas de R. ferruginea contra Plasmodium berghei, em modelo murino. Como controle positivo um grupo foi tratado com doses baixas de cloroquina (≤ 25 mg kg-1) e para controle negativo, um outro grupo foi mantido sem tratamento. O experimento causou até 48% de inibição de crescimento do parasita na dose de 1000 mg kg-1, e uma atividade limítrofe de 34% na dose de 500 mg kg-1, enquanto a cloroquina apresentou uma redução significativa de parasitemia (51-95%). Cosenza et al.17 avaliaram o potencial citotóxico, anti-hiperglicêmico e anti-hiperlipidêmico das cascas de R. ferruginea e os resultados não apresentaram citotoxidade nas concentrações de 1, 10, 100 e 1000 µg mL-1 frente as células renais (BMG) isoladas de mamíferos. Nos testes anti-hiperglicêmico e anti-hiperlipidêmico realizado com os camundongos nas concentrações de 50, 100 e 200 mg kg-1, o extrato mostrou redução apenas na dose de 200 mg kg-1 nos parâmetros bioquímicos (glicose, colesterol e triglicerídeos). O extrato etanólico de R. ferruginea induziu a absorção de lipídeos em ratos tratados com dieta hiperlipídica na concentração de 0,1 mg kg-1, além disso, o extrato apresentou um aumento da atividade da lipase lipoproteica.16 A análise de Ierobina® em ratos melhorou a absorção lipídica e teve efeitos espasmolíticos no íleo isolado, contudo, o fitoterápico conta em sua composição com extrato de Solanum paniculatum L., Jacaranda caroba (Vell.) DC. e Erythraea centaurium (L.) Borkh, ou seja, o extrato etanólico de R. ferruginea pode não ser a única responsável pela atividade biológica.20 Diaz et al.21 analisaram uma composição farmacêutica do extrato hidroalcoólico das partes aéreas do R. ferruginea em testes in vitro e in vivo. O teste in vitro foi realizado em culturas celulares de fibroblastos humano (NIH3T3) e apresentou atividade proliferativa de fibroblastos maior que o controle positivo (soro fetal bovino (SBF 5% e 10%) em todas as concentrações testadas (500, 250, 125, 62,50 e 31,25 µg mL-1). O teste in vivo foi realizado em modelo murino durante 21 dias com 4 dias de coleta (3º, 7º, 14º e 21º). Os resultados mostraram que nos dias de coleta os grupos de animais tratados com pomada contendo o extrato de R. ferruginea tiveram índice de contração maior quando comparados com o grupo contendo solução fisiológica e a pomada Fitoscar® (controle positivo). A atividade proliferativa de fibroblastos estimula o aumento do colágeno, contribuindo para o processo de cicatrização de feridas. Campana et al.22 analisaram o extrato etanólico das folhas frente a atividade anti-inflamatória de inibição TNF-α (fator de necrose tumoral alfa) em monócitos na concentração de 500 µg mL-1 e os resultados apresentaram 85,7% de inibição, quando comparado ao controle positivo (dexametasona). Remijiapedunculata (H.Karst.) Flueck. No levantamento realizado foi possível identificar poucos estudos sobre essa espécie, sendo que as principais substâncias isoladas foram os alcaloides cupreína (29) e quinina (30).23,24 Em relação a sua atividade biológica, García et al.25 analisaram o extrato aquoso das cascas frente a atividade anti-hiperglicêmica. O experimento foi desenvolvido através do teste in vitro de inibição enzimática de α-glicosidase, apresentando uma concentração inibitória (IC50) de 532,10 µg L-1. Remijia peruviana Standl. Díaz et al.12 isolaram e caracterizaram diversos alcaloides das folhas conhecidos como a quinamina (24), conquinamina (25), cinchonina (27) e a quinidina (31), além disso, cinco alcaloides foram descritos pela primeira vez, sendo eles remijinina (18), epiremijinina (19), 5-acetil-apocinchonamina (26), e dois derivados da cinchonina (27), N-acetil-deoxicinchonicinol (37) e N-acetil-cinchonicinol (38). Nas cascas de R. peruviana foram isolados e caracterizados a quinina (30), cupreína (29), cinchonina (27) e um possível artefato de cinchonina-HCl (32), além de dois novos alcaloides sendo eles acetilcupreína (33) e N-etil-quinina (34).10 Arana et al.13 analisaram as cascas e isolaram e caracterizaram três novos alcaloides: N-etil-quinina (34), acetato de quinina (35), quinina-álcool (36), além de dois relatados na literatura: quinina (30) e a cinchonina (27). Além disso, outros compostos como taninos, flavonoides, esteroides e saponinas foram identificados. R. peruviana apresenta um grande potencial químico, onde foram isoladas e identificadas 9 substâncias pela primeira vez, sendo sete alcaloides quinolínicos e dois alcaloides oxindólicos. Dessas 9 substâncias, 8 são encontradas apenas no gênero Remijia sendo elas: remijinina (18), epiremijinina (19), 5-acetil-apocinchonamina (26), acetilcupreína (33), N-etil-quinina (34), quinina-álcool (36) N-acetil-deoxicinchonicinol (37) e N-acetil-cinchonicinol (38) contribuindo para quimiotaxonomia da subfamília Cinchonoideae.8 Em relação à atividade biológica, Ruiz-Mesia et al.10 realizaram bioensaios com as substâncias isoladas das cascas de R. peruviana frente as espécies de insetos Spodoptera littoralis e Leptinotarsa decemlineata, atividade anti-Trypanosoma cruzi e citotoxicidade frente as células Sf9 (células do tecido ovariano pupal de Spodoptera frugiperda), células CHO (ovário de hamster chinês) e linhagens celulares tumorais: CT26 (carcinoma de camundongos BALB/c), SW480 (adenocarcinoma de cólon humano), HeLa (carcinoma epitelióide do colo de útero humano), SkMel25 (melanoma humano) e SkMel28 (melanoma humano maligno). Os alcaloides cupreína (29) e acetilcupreína (33) apresentaram efeitos antialimentares frente ao inseto L. decemlineata. A acetilcupreína (33) foi citotóxica para células CHO de mamíferos (ED50 (dose efetiva média) = 14,3 µg mL-1) e Sf9 de insetos (ED50 = 32,4 µg mL-1), após 48 h de incubação, enquanto cinchonina-HCl (32) apresentou uma citotoxicidade seletiva e forte para Sf9 (ED50 = 7,4 µg mL-1). Em relação a atividade anti-Trypanosoma cruzi, a quinina (30) teve efeito moderado (ED50 = 50 µg mL-1). O alcaloide acetilcupreína (33) apresentou citotoxicidade frente as linhagens CT26 (ED50 = 6,1 µg mL-1), SW480 (ED50 = 2,50 µg mL-1), HeLa (ED50 = 2,3 µg mL-1), SkMel25 (ED50 = 2,7 µg mL-1) e SkMel28 (ED50 = 5,3 µg mL-1). O possível artefato cinchonina-HCl (32) também apresentou citotoxicidade frente às linhagens tumorais CT26 (ED50 = 5,3 µg mL-1), SW480 (ED50 = 4,9 µg mL-1), HeLa (ED50 = 1,2 µg mL-1), SkMel25 (ED50 = 4,3 µg mL-1) e SkMel28 (ED50 = 0,6 µg mL-1). Em relação a atividade biológica, Ruiz-Mesia et al.10 sugeriram um mecanismo comum para as interações moleculares dos alcaloides quinolínicos que podem ter relação com a conformação 8R, 9S ou acetilação em C-6 com uma configuração 8S, 9R no esqueleto desses alcaloides, que podem influenciar diversas atividades biológicas. Kvist et al.26 analisaram as atividades antiplasmodial e antileishmanial in vitro do extrato etanólico do córtex de R. peruviana. O teste antiplasmodial foi realizado frente ao Plasmodium falciparum nas concentrações de 100, 50, 25 e 12 µg mL-1 e o extrato apresentou alta inibição nos parasitas (IC50 < 10 µg mL-1), quando comparada ao controle positivo (cloroquina). Essa atividade reforça a respeito dos conhecimentos tradicionais dos povos amazônicos, uma vez que eles utilizam de folhas, galhos e cascas das espécies de Remijia para sintomas relacionado à malária.12,13 A atividade anti-leishmania foi realizado frente a Leishmania major nas concentrações de 100, 50, 25 e 12 µg mL-1 e o extrato não apresentou atividade. Deharo et al.27 realizaram um estudo acerca de testes adequados para a inibição da biomineralização de ferriprotoporfirina IX para triagem de compostos antimaláricos. O extrato etanólico das cascas de R. peruviana apresentou uma concentração inibitória (IC50) de 0,7 mg L-1, validando o uso em triagem de produtos naturais. Posteriormente Bourdy et al.28 e Garavito et al.29 utilizaram esta espécie como controle positivo e os resultados apresentados foram semelhantes a biomineralização de ferriprotoporfirina (IC50 = 0,7 mg L-1). Além disso o extrato apresentou IC50 de 0,85 µg mL-1 frente ao Plasmodium falciparum e uma inibição de 92% contra Plasmodium berghei. Remijia purdieana Wedd. Essa espécie foi uma das primeiras estudadas quimicamente em 1884 por Hesse,30 resultando no isolamento dos alcaloides cinchonina (27) e cinchonamina (22). Em 1968, Kim30 reexaminou o extrato etanólico das cascas de R. purdieana e isolou novamente a cinchonina (27) e cinchonamina (22). White31 analisou novamente as cascas que resultou no isolamento da epicinchonamina (23). Considerando as descrições citadas na literatura a respeito da fitoquímica do gênero, observa-se que os metabólitos mais relatados foram: alcaloides (55%) [quinolínicos (32%), indólicos (18%) e oxindólicos (5%)], flavonoides (24%), ácidos fenólicos (13%), esteroides (5%) e triterpeno (3%) (Figura 7). Com isto, verifica-se que os alcaloides são os marcadores químicos do gênero, com uma grande preferência pelos alcaloides quinolínicos. Além do mais, as espécies apresentam diversas atividades biológicas, o que reforça o potencial para futuros ensaios com as substâncias isoladas e estudos visando a prospecção química das demais espécies.
CONCLUSÕES Os estudos químicos e biológicos realizados com espécies de Remijia spp. permitiram identificar 38 substâncias de diversas classes químicas como: alcaloides quinolínicos, alcaloides indólicos, alcaloides oxindólicos, flavonoides, ácidos fenólicos, esteroides e triterpeno. Seus extratos e substâncias demostraram ter atividade antioxidante, atividade anti-inflamatória de inibição TNF-α, antiplasmodial, cicatrizante, citotoxicidade, anti-Trypanosoma cruzi, antialimentares, antimalárica, anti-hiperlipidêmica, anti-hiperglicêmica e inibição da ferriprotoporfirina IX. A grande preferência observada pelas espécies de Remijia estudadas até o momento pela produção de alcaloides do tipo quinolínicos e indólicos indicam ser os marcadores quimiossistemáticos do gênero.
AGRADECIMENTOS Os autores agradecem ao Programa de Pós-Graduação em Ciências Biológicas (Botânica) do INPA, ao Programa de Pós-Graduação em Biotecnologia da UFAM, à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, F. G. S. agradece pela concessão da bolsa de mestrado; L. C. M. agradece pela concessão da bolsa de doutorado), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, G. S. C. agradece pela concessão da bolsa de doutorado; C. V. N. agradece pela concessão da bolsa de produtividade) e à Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM) pelos apoios financeiros e bolsas concedidas.
REFERÊNCIAS 1. Andersson, L.; Ann. Mo. Bot. Gard. 1995, 82, 409. [Crossref] 2. Flora e Funga do Brasil, Rubiaceae Juss., https://floradobrasil.jbrj.gov.br/consulta/ficha.html?idDadosListaBrasil=210, acessado em Março 2025. 3. Royal Botanic Gardens, Remijia DC., https://powo.science.kew.org/taxon/urn:lsid:ipni.org:names:35243-1, acessado em Março 2025. 4. Cardoso, D.; Särkinen, T.; Alexander, S.; Amorim, A. M.; Bittrich, V.; Celis, M.; Daly, D. C.; Fiaschi, P.; Funk, V. A.; Giacomin, L. L.; Goldenberg, R.; Heiden, G.; Iganci, J.; Kelloff, C. L.; Knapp, S.; de Lima, H. C.; Machado, A. F. P.; dos Santos, R. M.; Mello-Silva, R.; Michelangeli, F. A.; Mitchell, J.; Moonlight, P.; de Moraes, P. L. R.; Mori, S. A.; Nunes, T. S.; Pennington, T. D.; Pirani, J. R.; Prance, G. T.; de Queiroz, L. P.; Rapini, A.; Riina, R.; Rincon, C. A. V.; Roque, N.; Shimizu, G.; Sobral, M.; Stehmann, J. R.; Stevens, W. D.; Taylor, C. M.; Trovó, M.; van den Berg, C.; van der Werff, H.; Viana, P. L.; Zartman, C. E.; Forzza, R. C.; Proc. Natl. Acad. Sci. U. S. A. 2017, 114, 10695. [Crossref] 5. Fonseca, W. O.; Zappi, D.; Jardim, J.; Aona, L. Y. S.; Hoehnea 2020, 47, e462019. [Crossref] 6. WFO Plant List, Rubiaceae Juss., https://wfoplantlist.org/taxon/wfo-7000000534-2023-12?page=3, acessado em Março 2025. 7. Filogenia das RUBIACEAE (RubPP, português), 2024, https://www.researchgate.net/publication/355981527_Filogenia_das_RUBIACEAE_RubPP_portugues, acessado em Março 2025. 8. Martins, D.; Nunez, C. V.; Molecules 2015, 20, 13422. [Crossref] 9. Nascimento, R. R. G.; Pimenta, A. T. A.; de Lima Neto, P.; Cândido Júnior, J. R.; Costa-Lotufo, L. V.; Ferreira, E. G.; Tinoco, L. W.; Braz-Filho, R.; Silveira, E. R.; Lima, M. A. S.; J. Braz. Chem. Soc. 2015, 26, 1152. [Crossref] 10. Ruiz-Mesia, L.; Ruiz-Mesía, W.; Reina, M.; Martínez-Diaz, R.; de Inés, C.; Guadaño, A.; González-Coloma, A.; J. Agric. Food Chem. 2005, 53, 1921. [Crossref] 11. Sarandy, M. M.; Gusmão, L. J.; Purgato, G. A.; Píccolo, M. S.; da Matta, S. L. P.; Pizziolo, V. R.; Diaz-Munoz, G.; Diaz, M. A. N.; J. Ethnopharmacol. 2022, 296, 115464. [Crossref] 12. Díaz, J. G.; Sazatornil, J. G.; Rodríguez, M. L.; Mesía, L. R.; Arana, G. V.; J. Nat. Prod. 2004, 67, 1667. [Crossref] 13. Arana, G. E. V.; Ruiz-Mesía, L.; Ruiz-Mesía, W.; Reina, M.; Ciencia Amazónica (Iquitos) 2011, 1, 41. [Crossref] 14. Braga, F. C.; Valadares, Y. M.; Costa, M. A.; Lombardi, J. A.; de Oliveira, A. B.; Rev. Bras. Farmacogn. 2003, 13, 28. [Crossref] 15. Somavilla, N. S.; Cosenza, G. P.; Fagg, C. W.; Brandão, M. G. L.; Rev. Bras. Farmacogn. 2017, 27, 153. [Crossref] 16. Valadares, Y. M.: Remijia ferruginea D.C, Jacaranda caroba D.C e Solanum paniculatum L: Fitoquímica, Atividades Biológicas e Síntese de Derivados dos Ácido Ursólico e Oleanólico; Tese de Doutorado, Universidade Federal de Minas Gerais, Belo Horizonte, Brasil, 2009. [Link] acessado em Março 2025 17. Cosenza, G. P.; Viana, C. T. R.; Campos, P. P.; Kohlhoff, M.; Fagg, C. W.; Brandão, M. G. L.; J. Funct. Foods 2019, 54, 220. [Crossref] 18. Rodrigues, D. A.; Pereira, G. A. M.; Silva, A. A.; Santos, M. H.; Demuner, A. J.; Oliveira, P. M.; Planta Daninha 2019, 37, e019181108. [Crossref] 19. Andrade-Neto, V. F.; Brandão, M. G. L.; Stehmann, J. R.; Oliveira, L. A.; Krettli, A. U.; J. Ethnopharmacol. 2003, 87, 253. [Crossref] 20. Botion, L. M.; Ferreira, A. V. M.; Côrtes, S. F.; Lemos, V. S.; Braga, F. C.; J. Ethnopharmacol. 2005, 102, 137. [Crossref] 21. Diaz, M. A. N.; de Oliveira, T. T.; Pizziolo, V. R.; da Matta, S. L. P.; Gusmão, L. J.; BR 102016016548-2 B1 2021. 22. Campana, P. R. V.; Mansur, D. S.; Gusman, G. S.; Ferreira, D.; Teixeira, M. M.; Braga, F. C.; Phytother. Res. 2015, 29, 1509. [Crossref] 23. Montagnac, A.; Litaudon, M.; País, M.; Phytochemistry 1997, 46, 973. [Crossref] 24. Wisniak, J.; Rev. CENIC, Cienc. Biol. 2018, 49, 33. [Link] acessado em Março 2025 25. García, D.; Vásquez, D.; Peña, M.; Maco, M.; Aranda, J.; Villacrez, J.; Sotero, V.; VI Congreso Latinoamericano de Plantas Medicinales; Trujillo, Peru, 2018. [Link] acessado em Março 2025 26. Kvist, L. P.; Christensen, S. B.; Rasmussen, H. B.; Mejia, K.; Gonzalez, A.; J. Ethnopharmacol. 2006, 106, 390. [Crossref] 27. Deharo, E.; García, R. N.; Oporto, P.; Gimenez, A.; Sauvain, M.; Jullian, V.; Ginsburg, H.; Exp. Parasitol. 2002, 100, 252. [Crossref] 28. Bourdy, G.; Oporto, P.; Gimenez, A.; Deharo, E.; J. Ethnopharmacol. 2004, 93, 269. [Crossref] 29. Garavito, G.; Rincón, J.; Arteaga, L.; Hata, Y.; Bourdy, G.; Gimenez, A.; Pinzón, R.; Deharo, E.; J. Ethnopharmacol. 2006, 107, 460. [Crossref] 30. Kim, D. K.: I. Isolation and Proof of Structure of Some Alkaloids of Remijia purdieana Wedderly and II. An Investigation of Some Reactions of 2-Substituted Quinoxaline 1,4-Dioxides; PhD Thesis, Utah State University, Logan, Utah, 1968. [Link] acessado em Março 2025 31. White, J. A.: I. The alkaloids of Remijia purdieana Wedderly and II. The Hydrogen-Deuterium Exchange of Methyl Isothiazoles; PhD Thesis, Utah State University, Logan, Utah, 1969. [Link] acessado em Março 2025
Editor Convidado responsável pelo artigo: Lucas S. Abreu |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access