Artigo
|
|
| Obtenção de fase única de pentóxido de nióbio por uma rota simples e sua caracterização Obtaining single phase of niobium pentoxide by a simple route and its characterization |
|
Michelle D. A. Lage* Departamento de Engenharia de Minas, Escola de Engenharia, Universidade Federal de Minas Gerais, 31270-901 Belo Horizonte - MG, Brasil Recebido: 07/05/2024 *e-mail: michellealves07@gmail.com Brazil has the world's largest reserve of niobium (~98%) which turns niobium compounds into extremely interesting materials from a strategic point of view in the country. Niobium pentoxide is an n-type semiconductor that presents interesting physical and mechanical properties. The presence of polymorphic phases on Nb2O5 powders has several implications from the scientific and application point of view. It is known that the H-phase is thermodynamically stable and can be obtained easily from amorphous Nb2O5 after heat treatment. In this work, niobic acid (Nb2O5.nH2O) produced by the Brazilian company CBMM has been used as the starting material to grow unique monoclinic P2 space group H-Nb2O5 crystals through a simple calcination route. The obtained material has been characterized by XRD (X-ray diffraction), SEM (scanning electron microscopy), TEM (transmission electron microscopy) and micro-Raman and submitted to cyclic voltammetry measurements. The characterization results confirm that H-Nb2O5 crystallized in the monoclinic P2 space group. INTRODUÇÃO O pentóxido de nióbio é um semicondutor do tipo n que apresenta muitas propriedades diferentes e interessantes, tornando-o um material versátil. Devido a sua complexidade estrutural, nove formas polimórficas foram relatadas para o Nb2O5. A formação de tais fases polimórficas pode ser muito complexa, necessitando de métodos específicos para obtenção e caracterização de pós de Nb2O5 monofásicos. As fases mais comuns são a pseudohexagonal (TT-Nb2O5), ortorrômbica (T-Nb2O5), tetragonal (M-Nb2O5) e monoclínica (H-Nb2O5) e sua formação está associada à temperatura.1,2 A presença de fases polimórficas em pós de Nb2O5 tem diversas implicações do ponto de vista científico e de aplicação. Por um lado, a existência de mais de uma fase compromete a correlação entre os diferentes métodos de síntese com as suas propriedades, uma vez que é quase impossível saber a contribuição de cada fase para uma propriedade física específica.3 Alguns autores afirmam que a coexistência de duas ou mais fases pode impactar nas propriedades químicas e físicas do Nb2O5.4 Em artigos recentes,5,6 pós comerciais de Nb2O5 recebidos de diferentes produtores continham diferentes polimorfos. Sabe-se que a fase H é termodinamicamente estável e pode ser facilmente obtida a partir de Nb2O5 amorfo após tratamento térmico sem qualquer controle atmosférico.7 A fase única H-Nb2O5 atende a uma gama relativamente ampla de aplicações, como capacitores cerâmicos, implantes médicos, componentes microeletrônicos, catálise, filmes ópticos e lentes. Mais recentemente, essa fase vem sendo explorada como anodo em baterias de íons lítio.1,2,8 É sabido que, comparativamente com a fase bronze metaestável T-Nb2O5, principalmente levando-se em conta os efeitos de pseudocapacitância de intercalação, a fase H-Nb2O5 ainda apresenta um desempenho pior, principalmente em taxas de corrente mais elevadas, tornando essa fase mais adequada para aplicações estacionárias, onde a exigência por densidade de potência é menor em comparação a aplicações em veículos elétricos. Essa diferença ocorre devido a características estruturais como a ausência de bipirâmides pentagonais de Nb-O.9 A estrutura cristalina do H-Nb2O5 monoclínico limita a difusão de Li+, que reduz seu desempenho de taxa, mas suporta maior capacidade de carga. Ding et al.10 atribuem a falha de desempenho do H-Nb2O5 à anisotropia da condução de elétrons e íons dentro dos cristais de H-Nb2O5. Os pesquisadores empregaram uma estratégia envolvendo a utilização de carbono amorfo como um revestimento uniforme na superfície de partículas de H-Nb2O5 em escala micrométrica. Isso serve para homogeneizar o transporte de elétrons e Li+. Além disso, Li et al.11 obtiveram uma fase H-Nb2O5 com defeitos planares de Wadsley e demonstraram que d-H-Nb2O5 defeituoso exibe uma capacidade de intercalação muito maior do que H-Nb2O5 bem cristalizado. No Brasil, na cidade de Araxá, Minas Gerais, encontra-se a maior jazida lavrável de pirocloro do mundo, com 742 Mt dispostas a céu aberto numa área de 4,5 km de 5 diâmetro, seguida pelas minas de Catalão e Ouvidor, no estado de Goiás, com 82,3 Mt de minérios, o que fez com que esses dois estados fossem responsáveis por quase 97% da produção beneficiária do nióbio em todo Brasil, fazendo dele um material extremamente interessante do ponto de vista estratégico no país.12,13 Neste estudo, o ácido nióbico amorfo (Nb2O5.nH2O), produzido pela Empresa Brasileira de Metalurgia e Mineração (CBMM), extraído da região do triângulo mineiro do estado de Minas Gerais, no Brasil, foi tratado termicamente para obtenção da fase monoclínica única (H-Nb2O5). Foram realizadas as caracterizações estrutural e morfológica do material e uma caracterização eletroquímica preliminar para investigar a viabilidade inicial do material como anodo em baterias de íons Li.
PARTE EXPERIMENTAL Síntese e caracterização dos sólidos Cristais de Nb2O5 foram produzidos a partir do aquecimento do ácido nióbico (Nb2O5.nH2O) (fornecido pela CBMM) em uma mufla a 1100 ºC por 3 h. Os sólidos foram caracterizados por fluorescência de raios-X (FRX), análise termogravimétrica (TGA), varredura diferencial de calorimetria (DSC), difração de raios-X (DRX), espectroscopia Raman e microscopia eletrônica de transmissão (MET). A composição química do ácido nióbico foi analisada em um espectrômetro de FRX com dispersão de comprimento de onda (WDXRD ARL PERFORM'X, Thermo Scientific GEN-X 4200W) com tubo de Rd (5GNf Rh 50u). Um sistema STA 6000 (PerkinElmer) foi usado para as análises de TGA/DSC. A fim de utilizar condições similares a da calcinação, o ácido nióbico foi colocado em um cadinho de alumina exposto a fluxo de ar (20 mL min-1). A amostra foi aquecida a uma taxa de 10 ºC min-1 de 30 a 1000 ºC. As análises de DRX foram realizadas utilizando um Difratômetro de Raios X PHILIPS (PANalytical, controlador PW3710/31, gerador PW1830/10 e detector PW3020/00) sob as seguintes condições de operação: radiação CuKα (35 kV, 40 mA), passo de 0,02º 2θ, com tempo de contagem de 1 segundo por passo e faixa de 10º a 80º 2θ. A interpretação do difratograma foi realizada comparando padrões contidos no banco de dados PDF 02 do software PANalytical X'Pert HighScore Plus. A espectroscopia Raman foi realizada com espectrômetro Jobin Yvon Horiba LABRAM - HR800, equipado com laser He-Ne de 632,8 nm, acoplado ao microscópio Olympus BX-41. Os espectros foram adquiridos com potência de laser de 0,08 mW e faixa de frequência de 100-1100 cm-1. As análises de microscopia eletrônica de varredura (MEV) e microscopia eletrônica de transmissão (MET) foram realizadas utilizando os equipamentos FEI Quanta 3D FEG - Quanta 3D e Tecnai G2-20, SuperTwin FEI (200 kV), respectivamente, no Centro de Microscopia da UFMG. O preparo da amostra consistiu na dispersão das partículas em álcool etílico por 10 min em banho ultrassônico, seguido de gotejamento da amostra sobre grade de carbono. Preparação do eletrodo O eletrodo foi fabricado utilizando-se a proporção de 75:20:5 (% em massa) de material ativo, carbono (Vulcan XC2, Cabot) como agente condutor e fluoreto de polivinilideno (PVDF) dissolvido em 1-metil-2-pirrolidona (NMP, Sigma-Aldrich, 99,5%, anidro) como ligante, respectivamente. A proporção aplicada, de 75:20:5, foi escolhida com base na literatura.14 Os materiais foram misturados formando-se uma pasta de eletrodo, que foi depositada em folha de cobre previamente seca em estufa com circulação de ar a 80 ºC por 12 h, de forma a cobrir uma área de 1 cm2. A pasta foi depositada com espessura aproximada de 20 µm a fim de se atingir uma massa de material ativo de aproximadamente 1.0-1.5 mg cm-2. A placa foi seca a temperatura ambiente por 12 h e, em seguida, colocada em estufa com circulação de ar por um período de 30 min a 40 ºC, seguido por mais 30 min a 60 ºC e por 12 h a 80 ºC. Após a secagem, os eletrodos foram caracterizados através da técnica de microscopia eletrônica de varredura. Medidas eletroquímicas As caracterizações eletroquímicas foram realizadas em celas eletroquímicas de três eletrodos, utilizando-se lítio metálico como eletrodo de referência e contra-eletrodo. Foram utilizadas células eletroquímicas do tipo swagelok construídas em PVC (policloreto de vinila) e aço inoxidável, sendo completamente vedadas após fechamento pelo uso de anéis O-rings. Este tipo de célula faz com que os eletrodos de trabalho, referência e contra-eletrodos fiquem bem próximos (zero gap cell), sendo aplicados separadores do tipo membranas de polipropileno (Celgard 2400), que atuam como um isolamento elétrico entre os eletrodos permitindo, portanto, a penetração do eletrólito e a difusão iônica. A montagem das células eletroquímicas foi realizada dentro de câmaras secas do tipo glove-box (Glove Box, Mbraum, Lab Master 100) com atmosfera de argônio e umidade menor que 5 ppm. Para a caracterização do material utilizou-se como eletrólito o hexafluorfosfato de lítio (LiPF6, 1 mol L-1) dissolvido em etileno carbonato (EC) e carbonato dimetileno (DMC), na proporção 1:1 v/v (Selectpur, Merck). Foram empregadas as técnicas de voltametria cíclica (VC) na janela de potencial entre 0,5 e 3,0 V vs. Li/Li+ na velocidade de varredura de 0,5 mV s-1 e espectroscopia de impedância eletroquímica (EIE) na faixa de frequência de 0,01 Hz a 10.000 Hz em OCP (potencial de circuito aberto) com amplitude de 0,1 mV, em um potenciostato Autolab da Metrohm.
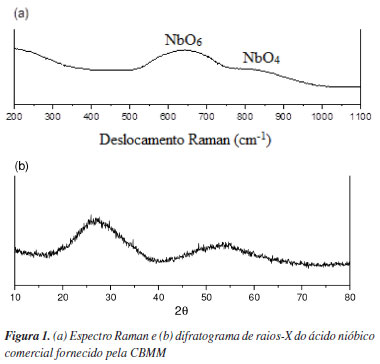
RESULTADOS E DISCUSSÃO Caracterização dos sólidos A Figura 1 mostra o espectro Raman e o difratograma de DRX do ácido nióbico. O ácido nióbico é amorfo e seu espectro Raman (Figura 1a) apresenta bandas pouco definidas, ou seja, as bandas Raman características observadas são muito amplas. A banda Raman centrada em ~640 cm-1 corresponde à vibração do octaedro NbO6 distorcido. A banda característica em ~840 cm-1 corresponde à vibração do tetraedro NbO4 distorcido.15 O difratograma de DRX do ácido nióbico (Figura 1b) apresenta dois picos de difração alargados, o primeiro pico em 27º e o segundo em 53º. Tal alargamento dos padrões de difração de DRX é característico de ácidos nióbicos amorfos.16
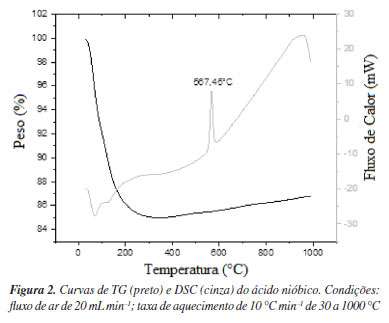
Medidas de FRX do ácido nióbico mostraram que ele é composto de 99% de Nb2O5. O conteúdo de H2O no ácido nióbico foi medido pela curva TG (Figura 2, curva preta). Uma diminuição gradual do peso com o aumento da temperatura (de 30 para 300 ºC) indica a perda gradual de água durante o aquecimento da amostra. A perda de H2O ocorreu em duas etapas; a primeira etapa foi de 30 a 100 ºC (água fisissorvida), enquanto a segunda etapa foi de 100 a 300 ºC (água cristalina). Observou-se maior diminuição no peso para a água fisissorvida e menor para a água cristalina, e o valor de n no ácido nióbico (Nb2O5.nH2O) foi avaliado em 1,46. A curva DSC (Figura 2, curva cinza) mostra um pico exotérmico em ~567,45 ºC correspondente à transição do Nb2O5 amorfo para a fase cristalina T-Nb2O5. A outra transição de fase em torno de 950 ºC é atribuída à transformação de T-Nb2O5 em H-Nb2O5.16 O amplo pico exotérmico indica que a segunda transição é um processo cineticamente lento.
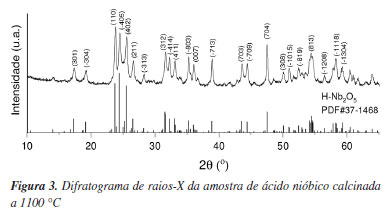
O DRX da amostra obtida após a calcinação do ácido nióbico a 1100 ºC (Figura 3) mostra um padrão de difração característico da fase H-Nb2O5 (PDF#37-1468) com estrutura monoclínica, grupo espacial P2 e parâmetros de rede a = 20,3810 Å, b = 3,8249 Å, c = 19,3680 Å, α = 90º, β = 115,694º e γ = 90º (Figura 4).18 Essa estrutura cristalográfica oferece canais de difusão de Li+ semelhantes a túneis abertos ao longo de cada cristal. Mas os canais para difusão são descontínuos no plano c-a. Portanto, a fase H-Nb2O5 apresenta natureza anisotrópica para intercalação e des-intercalação de Li+.
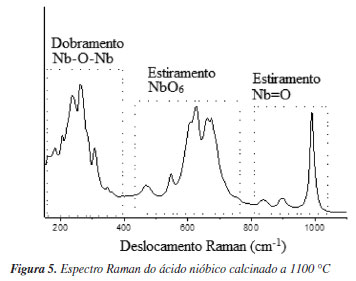
O espectro Raman do ácido nióbico calcinado (Figura 5) mostra picos característicos da fase H-Nb2O5, mostrando os modos de flexão da ligação Nb-O-Nb em 200-400 cm-1, os modos de estiramento do NbO6 em 400-800 cm-1. A formação de dupleto em 630 e 670 cm-1 e os modos de estiramento da ligação de ordem superior (ligação terminal Nb=O) em 838, 897 e 990 cm-1 são característicos do H-Nb2O5 cristalino.19
A imagem de MEV (Figura 6a) mostra que a amostra de ácido nióbico calcinado a 1100 ºC é densa com presença de coalescência entre as partículas. A imagem de MET de alta resolução (Figura 6b) mostra franjas de interferência com um espaçamento de 0,375 nm que correspondem ao plano (110) da fase Nb2O5 monoclínica, com grupo espacial P2 e parâmetros de rede a = 20,3810 Å, b = 3,8249 Å, c = 19,3680 Å, α = 90º, β = 115,694º e γ = 90º, correspondente à ficha PDF#37-1468. O espaçamento entre as franjas foi calculado no software ImageJ20 através da aplicação dos filtros de transformada de Fourier (FFT) e transformada de Fourier inversa (IFFT). A Figura 6c mostra a FFT da área destacada na Figura 6b com o ponto de Bragg g1 destacado. A Figura 6d mostra a IFFT do ponto g1 com suas franjas de interferência. A análise sugere que as franjas de interferência da direção g1 não apresentam variação no espaçamento entre os planos cristalográficos, indicando que não há defeitos pontuais.
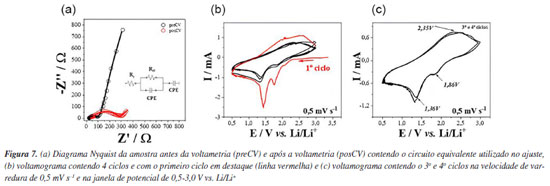
Investigação das propriedades eletroquímicas do Nb2O5 O interesse por materiais eletroativos contendo nióbio para dispositivos de armazenamento de energia emergiu com a investigação e desenvolvimento de materiais pseudocapacitivos, como óxidos como TiO2, RuO2 e Li4Ti5O12. Materiais como Nb2O5 são ditos pseudocapacitivos quando capazes de armazenar energia através de processos capacitivos e faradaicos ao mesmo tempo.21 O tratamento termodinâmico dos processos eletroquímicos faz emergir uma grandeza física denominada pseudocapacitância, conceito largamente difundido por Conway21 que explica que a origem da pseudocapacitância pode se dar por diferentes mecanismos, mas que essencialmente se dá a partir de reações redox rápidas e reversíveis que ocorrem na superfície do eletrodo e que pode alcançar valores muito acima do que os de capacitância clássica. Na Figura 7a é possível observar a mudança do diagrama Nyquist da amostra após 4 ciclos de voltametria. A espectroscopia de impedância eletroquímica (EIE) é uma técnica capaz de elucidar aspectos estruturais da interface do eletrodo como os aqui analisados. O circuito equivalente obtido após o ajuste do diagrama Nyquist (Figura 7a) é composto pela resistência ôhmica da solução eletrolítica (eletrólito) entre o anodo e eletrodo de referência, representado aqui por Rs, cujo valor depende essencialmente do eletrólito e da disposição do sistema (célula eletroquímica empregada), pela resistência de transferência de carga Rct que está relacionada com cinética das reações faradaicas ocorridas na superfície do eletrodo, pela capacitância oriunda da formação da dupla camada elétrica que aqui é obtida através de elemento de fase constante (Cpe), que pode ser entendido como um capacitor imperfeito, que modela o comportamento da dupla camada elétrica tomando em conta as imperfeições dos sistemas reais tais como baixa homogeneidade morfológica e rugosidade da superfície.
Após o ajuste com circuito equivalente, foi possível determinar que a resistência ôhmica aumentou de Rs = 24 Ω para Rs = 44 Ω e que a resistência de transferência de carga aumentou de Rct = 73 Ω para Rct = 243 Ω. Esse aumento dos valores das resistências está relacionado à formação da camada de passivação chamada SEI (solid electrolyte interface) que é resultado da decomposição do eletrólito em valores de potencial < 1 V vs. Li/Li+ e transições de fase ocorridas durante a inserção/desinserção dos íons de lítio. O processo de inserção/desinserção dos íons de lítio na estrutura do Nb2O5 cristalino é descrito na literatura21 pela Equação 1 abaixo, em que o valor máximo de x = 2, alcançando a capacidade específica teórica máxima de 200 mA h g-1. 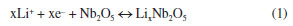 Na voltametria cíclica é possível observar o primeiro ciclo no voltamograma da Figura 7b (cor vermelha), no qual podemos observar 2 picos catódicos bem destacados em ~1,9 e ~1,5 V, não sendo observados picos anódicos bem definidos, apenas uma região na forma de ombro em ~2,86 V. Nos ciclos subsequentes, esses picos redox tornam-se menos destacados, sendo o 3o e 4o ciclos praticamente coincidentes, denotando uma possível estabilização do processo de mudança estrutural. A diminuição da área sob a curva dos ciclos após o primeiro ciclo está relacionada com a perda irreversível de capacidade durante o primeiro ciclo. Essa perda de capacidade está relacionada com a formação da SEI e transições de fase irreversíveis. A atividade eletroquímica do material ativo está relacionada com picos redox que correspondem às mudanças Nb5+ → Nb4+ e Nb4+ → Nb3+. Os picos redox estão mais bem definidos no primeiro ciclo, tornando-se menos definidos nos ciclos subsequentes, sugerindo que o processo de armazenamento de carga elétrica ocorre, principalmente, por fenômenos faradaicos (inserção de íons de lítio e reações redox de superfície), o que é consistente com o já observado com materiais anódicos à base de nióbio.22 Em geral, óxidos à base de Nb são candidatos promissores como materiais anódicos de alta densidade de potência, principalmente por esta classe de materiais possuírem comportamento pseudocapacitivo. A fase H-Nb2O5, apesar de apresentar valores de capacidade específica de até 250 mA h g-1, tem enfrentado desafios relacionados à baixa ciclabilidade e acentuada perda de carga (fading capacity) oriunda da dupla transição de fase durante o processo de de-litiação.23
CONCLUSÕES Os óxidos à base de nióbio são considerados de grande potencial para aplicação como anodos em baterias de íons lítio. Neste trabalho, foi possível obter um óxido de nióbio de fase única a partir da calcinação de um ácido nióbico desenvolvido no Brasil. O ácido nióbico apresentou 99% de pureza e seu valor n (Nb2O5.nH2O) foi avaliado em 1,46. A curva DSC mostrou os picos exotérmicos de transição do Nb2O5 amorfo para a fase cristalina T-Nb2O5 e da transformação de T-Nb2O5 em H-Nb2O5 em ~567 e 950 ºC, respectivamente. A caracterização do sólido obtido após calcinação a 1100 ºC mostra que a fase monoclínica de grupo espacial P2, H-Nb2O5, foi formada. A caracterização eletroquímica demonstrou sua viabilidade como candidato a material anódico de baterias de íons-lítio. As propriedades pseudocapacitivas que tornam materiais a base de nióbio excelentes candidatos para dispositivos de alta densidade de potência enfrentam importantes desafios tecnológicos como a baixa ciclabilidade e acentuada perda de carga (fading capacity). A superação desses desafios tem passado por estratégias que visam melhorar as propriedades eletroquímicas, investigando e aprimorando morfologia, área superficial, resistência mecânica, cinética de transporte de massa e elétrons, e condutividade eletrônica dos óxidos. Dentre as estratégias que podem ser empregadas para melhorar o material aqui investigado está o seu emprego na forma de compósitos com materiais de carbono, já que esses são capazes de suportar o estresse mecânico e aumentar a condutividade do eletrodo, elevando a ciclabilidade do eletrodo, e a dopagem com elementos que podem introduzir mais sítios ativos na estrutura.
AGRADECIMENTOS Os autores gostariam de agradecer à agência de fomento federal brasileira CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico) pelos auxílios de pesquisa 408563/2022- 2 e 308523/2022-9. Os autores também agradecem ao Centro de Microscopia da Universidade Federal de Minas Gerais (CM-UFMG) pelas análises de MEV e MET, ao Laboratório de Caracterização do DEMIN-UFMG pelas análises de FRX e DRX, ao Laboratório Raman do DEMET-UFMG pelas análises de Espectroscopia Raman, ao Laboratório de Química de Nanoestruturas de Carbono (LQN) do CDTN pelas análises de TG e ao Grupo de Eletrocatálise e Eletroquímica Ambiental de Ribeirão Preto da USP pelas análises de voltametria cíclica e impedância.
REFERÊNCIAS 1. Pang, R.; Wang, Z.; Li, J.; Chen, K.; Materials 2023, 16, 6956. [Crossref] 2. Nico, C.; Monteiro, T.; Graça, M. P. F.; Prog. Mater. Sci. 2016, 80, 1. [Crossref] 3. Ko, E. I.; Weissman, J. G.; Catal. Today 1990, 8, 27. [Crossref] 4. Hreščak, J.; Bencan, A.; Rojac, T.; Malič, B.; J. Eur. Ceram. Soc. 2013, 33, 3065. [Crossref] 5. Pilarek, B.; Pelczarska, A. J.; Szczygieł, I.; J. Therm. Anal. Calorim. 2017, 130, 77. [Crossref] 6. Lin, J.; Zhao, S.; Tranter, T. G.; Zhang, Z.; Peng, F.; Brett, D.; Jervis, R.; Shearing, P. R.; Electrochim. Acta 2023, 443, 141983. [Crossref] 7. da Cruz, J. A.; Volnistem, E. A.; Ferreira, R. F.; Freitas, D. B.; Sales, A. J. M.; Costa, L. C.; Graça, M. P. F.; Therm. Sci. Eng. Prog. 2021, 25, 101015. [Crossref] 8. Lin, J.; Zhao, S.; Jervis, R.; Shearing, P.; ChemElectroChem 2024, 11, e202300581. [Crossref] 9. Cao, D.; Yao, Z.; Liu, J.; Zhang, J.; Li, C.; Energy Storage Materials 2018, 11, 152. [Crossref] 10. Ding, H.; Song, Z.; Zhang, H.; Zhang, H.; Li, X.; Mater. Today Nano 2020, 11, 100082. [Crossref] 11. Li, T.; Nam, G.; Liu, K.; Wang, J. H.; Zhao, B.; Ding, Y.; Soule, L.; Avdeev, M.; Luo, Z.; Zhang, W.; Yuan, T.; Jing, P.; Kim, M. G.; Song, Y.; Liu, M.; Energy Environ. Sci. 2022, 15, 254. [Crossref] 12. Alves, A. R.; Coutinho, A. D.; Mater. Res. 2015, 18, 106. [Crossref] 13. de Sousa, R. M. F.; Fernandes, L. E.; Guerra, W.; Quim. Nova Esc. 2013, 35, 68. [Link] acessado em Abril 2025 14. Han, J.-T.; Liu, D.-Q.; Song, S.-H.; Kim, Y.; Goodenough, J. B.; Chem. Mater. 2009, 21, 4753. [Crossref] 15. Nakajima, K.; Baba, Y.; Noma, R.; Kitano, M.; Kondo, J. N.; Hayashi, S.; Hara, M.; J. Am. Chem. Soc. 2011, 133, 4224. [Crossref] 16. Liang, F.; Wu, D.; Jiang, L.; Zhang, Z.; Zhang, W.; Rui, Y.; Tang, B.; Liu, F.; ACS Appl. Mater. Interfaces 2021, 13, 51057. [Crossref] 17. Momma, K.; Izumi, F.; J. Appl. Crystallogr. 2011, 44, 1272. [Crossref] 18. Gatehouse, B.; Wadsley, A.; Acta Crystallogr. 1964, 17, 1545. [Crossref] 19. Pittman, R. M.; Bell, A. T.; J. Phys. Chem. 1993, 97, 12178. [Crossref] 20. Schneider, C.; Rasband, W.; Eliceiri, K.; Nat. Methods 2012, 9, 671. [Crossref] 21. Conway, B. E.; Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications; Springer Science & Business Media: New York, 2013. 22. Song, Z.; Li, H.; Liu, W.; Zhang, H.; Yan, J.; Tang, Y.; Huang, J.; Zhang, H.; Li, X.; Adv. Mater. 2020, 32, 2001001. [Crossref] 23. Meng, J.; He, Q.; Xu, L.; Zhang, X.; Liu, F.; Wang, X.; Li, Q.; Xu, X.; Zhang, G.; Niu, C.; Xiao, Z.; Liu, Z.; Zhu, Z.; Yan, Z.; Mai, L.; Adv. Energy Mater. 2019, 9, 1802695. [Crossref]
Editor Associado responsável pelo artigo: Lucia Mascaro |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access