Artigo
|
|
| Sensor eletroquímico baseado em óxido de grafeno reduzido e estanato de zinco para determinação de prometazina Electrochemical sensor based on reduced graphene oxide and zinc stannate for promethazine determination |
|
Andreza L. MoreiraI; Janevane S. de CastroI,II; Anderson V. ChavesI; Pierre B. A. FechineI; Pedro de Lima-NetoI,; I. Departamento de Química Analítica e Físico-Química, Centro de Ciências, Universidade Federal do Ceará, Campus do Pici, 60440-900 Fortaleza - CE, Brasil Recebido: 01/12/2024 *e-mail: adriana@ufc.br An innovative sensor, based on a glassy carbon electrode modified with a reduced graphene oxide and zinc stannate composite (Zn2SnO4-rGO/GCE), was developed to detect and quantify promethazine hydrochloride (PMZ) in pharmaceutical formulations, using square wave voltammetry (SWV). The morphology of the sensor was analyzed by scanning electron microscopy (SEM), which revealed the aggregation of rGO and Zn2SnO4 species. The chemical interaction between the components was investigated by electrochemical impedance spectroscopy (EIS) and cyclic voltammetry (CV), showing lower charge transfer resistance and higher analytical signal in the PMZ oxidation process. The optimized analysis conditions (McIlvaine buffer pH 5.0, frequency of 80 s-1, amplitude of 25 mV and increment of 2 mV) resulted in a linear analytical curve in the range of 1.48 × 10-7 to 6.48 × 10-6 mol L-1, with low detection (1.24 × 10-8 mol L-1) and quantification (3.76 × 10-8 mol L-1) limits. The sensor demonstrated high repeatability (%RSD, relative standard deviation = 1.54) and reproducibility (%RSD = 1.89) and was effective in the analysis of PMZ in pharmaceutical samples, presenting a recovery rate of 96.62%, proving its applicability in pharmaceutical analysis. INTRODUÇÃO Cloridrato de prometazina (PMZ, nome IUPAC: cloridrato de ((RS)-N,N-dimetil-1-(10H-fenotiazina-10-il)propano-2-amina)1 é um fármaco pertencente ao grupo das fenotiazinas, conhecido por apresentar ação anti-histamínica, antiemética, sedativa, anticolinérgica e analgésica. Sendo assim, é recomendado para o controle de reações alérgicas, tonturas, vômitos e náuseas, além do uso em procedimentos pré e pós-cirúrgicos, na potencialização de analgésicos e redução da ansiedade.2-4 Contudo, seu uso pode provocar alguns efeitos adversos, como problemas respiratórios, taquicardia, hipertensão ou hipotensão; por isso, seu monitoramento é importante, visto que o consumo generalizado de PMZ vem aumentando nos últimos anos.3,4 A monitorização de fármacos em formulações farmacêuticas é essencial para garantir a segurança e eficiência terapêutica dos medicamentos; ademais, a presença da PMZ em matrizes ambientais tem sido cada vez mais relatada, demonstrando-se claramente a necessidade de monitorá-la tendo em vista tratar-se de um contaminante emergente de impactos ainda desconhecidos.5,6 Destarte, métodos de análise sensíveis e seletivos para a detecção desse fármaco são fundamentais tanto para o controle de qualidade de medicamentos quanto para a análise ambiental. Dentre as técnicas utilizadas na determinação de PMZ, destacam-se a cromatografia líquida de alta eficiência (CLAE) e a espectrofotometria ultravioleta visível (UV-Vis), muito embora, apesar da alta precisão, demandem instrumentação de alto custo, uso de solventes orgânicos, geração de muitos resíduos químicos e pré-tratamento laborioso das amostras.7-9 Nesse contexto, sensores eletroquímicos apresentam-se como alternativas promissoras, oferecendo baixo custo, rapidez, elevada sensibilidade, e por vezes, faixas de trabalho ampliadas e menores limites de detecção e quantificação do analito investigado, quando comparados às técnicas cromatográficas e espectrofotométricas.10 Com a nanotecnologia em expansão, o uso de nanomateriais no desenvolvimento de dispositivos sensores vem sendo estudado. Trabalhos recentes11-13 demonstram que a integração de nanomateriais carbonáceos, como nanotubos e óxidos de grafeno, juntamente com materiais nanometálicos, melhora significativamente a sensibilidade e a seletividade de medições eletroquímicas, o que demonstra avanços na detecção de fármacos. Por exemplo, o uso de nanotubos de polipirrol decorados com óxido de cádmio e óxido de grafeno em conjunto com óxido de zinco resultou em um aumento significativo na eficiência de detecção do PMZ, quando comparado aos eletrodos convencionais.14-16 A associação de óxidos de grafeno com óxidos metálicos no desenvolvimento de sensores eletroquímicos para detecção de fármacos é descrita na literatura17-19 e se mostra bem-sucedida. O grafeno tem atraído atenção por apresentar características como alta área superficial e boa condutividade elétrica e térmica, tornando-o um dos materiais comumente utilizados no desenvolvimento de sensores químicos.20-22 Entretanto, a utilização do grafeno puro é dificultada por causa de sua baixa solubilidade e pela tendência de formação de aglomerados, além da dificuldade em sua síntese. Por isso, os óxidos de grafeno são comumente utilizados como alternativa, sendo o óxido de grafeno reduzido (OGr) o que mais se aproxima em estrutura e características ao grafeno.22,23 O óxido metálico estanato de zinco (Zn2SnO4) é reconhecido por sua elevada mobilidade eletrônica, condutividade elétrica e boa estabilidade.24 Por esse motivo, é encontrado em diversas aplicações e em vários sistemas químicos, incluindo fotocatalisadores, células solares, baterias e sensores de gases, todos os quais produziram resultados promissores.25-29 Deste modo, o Zn2SnO4 surge como material de estudo interessante para pesquisas voltadas ao desenvolvimento de sensores para identificar substâncias em diferentes meios. Diversos sensores eletroquímicos têm sido desenvolvidos para a determinação de PMZ, empregando diferentes materiais modificadores e técnicas voltamétricas para otimização da resposta analítica. Um dos estudos14 propôs um eletrodo de carbono vítreo comercial (ECV) modificado com Bi2S3 dopado com níquel, desenvolvido e aplicado por meio da amperometria em tampão fosfato salino 0,05 mol L-1, apresentando faixa linear de trabalho de 1 nmol L-1 a 163,17 µmol L-1, e limite de detecção (LD) igual a 0,4 nmol L-1. Outro trabalho30 desenvolveu um sensor baseado em ECV modificado com nanotubos de carbono funcionalizados com polietilenimina, utilizando voltametria de onda quadrada (VOQ) em tampão Sörensen (pH 2,0) exibindo faixa linear de trabalho de 0,497 a 5,03 µmol L-1, e LD de 0,231 µmol L-1. Em uma pesquisa mais recente,14 foi construído um sensor usando ECV modificado com CdO decorado com nanotubos de polipirrol, empregando voltametria de pulso diferencial (VPD) em tampão fosfato salino (pH 7,0), apresentando faixa linear de trabalho de 50 a 550 µmol L-1, e LD de 10,83 nmol L-1. Recentemente, foi construído um sensor formado por ECV modificado com um compósito à base de OGr e Zn2SnO4 para ser aplicado pela primeira vez na detecção de fármacos, utilizando ofloxacino.31 Como o desenvolvimento de sensores que oferecem novos insights para a identificação rápida e precisa de diferentes compostos químicos usando um único método é importante no campo das determinações eletroquímicas; com perspectivas promissoras, este estudo sugere o uso do ECV/OGr-Zn2SnO4 para detecção de PMZ.
PARTE EXPERIMENTAL Reagentes e soluções As substâncias PMZ (99,8%), OGr (C ≥ 75%, O ≤ 22%) e Nafion® (95,0%) foram adquiridos da Sigma-Aldrich®. As amostras de comprimidos de Fenergan® (25 mg) foram adquiridas em comércio local. O Zn2SnO4 foi sintetizado a partir de Zn(CH3COO)2.2H2O (98,0%) e SnCl2.2H2O (98,0%), adquiridos da Dinâmica®. Os padrões de PMZ 1,0 × 10-3 mol L-1 foram preparados pela dissolução de uma determinada quantidade em etanol (96%) e armazenados ao abrigo da luz para evitar degradação. Todas as soluções foram preparadas com reagentes de grau analítico e com água purificada pelo sistema Milli-Q® (resistividade 18,2 MΩ cm, Millipore, Inc.). A solução K4[Fe(CN)6]/K3[Fe(CN)6] (1:1) 1,0 × 10-3 mol L-1 foi preparada em meio KCl 1,0 × 10-1 mol L-1. As soluções tampões utilizadas como eletrólitos de suporte foram: Britton-Robinson (BR, preparado da mistura equimolar de C2H4O2, H3BO3 e H3PO4 0,4 mol L-1 com pH ajustado pela adição NaOH 2,0 mol L-1), Mcllvaine (preparado pela mistura de C6H8O7 0,1 mol L-1 e Na2HPO4 0,2 mol L-1), Sörensen (preparado pela mistura de KH2PO4 0,1 mol L-1 e Na2HPO4 0,1 mol L-1) e biftalato de potássio (preparado pela mistura de C8H5KO4 0,1 mol L-1 e NaOH 0,1 mol L-1). Equipamentos Para a realização dos experimentos eletroquímicos foi utilizado potenciostato/galvanostato PGSTAT 101 (Metrohm-Eco Chemie), controlado por computador por meio do programa Nova, versão 2.1.5, e célula eletroquímica convencional equipada com ECV (BASi diâmetro de 3 mm) utilizado como eletrodo de trabalho, Ag(s)/AgCl(s)/KClsaturado como eletrodo de referência e folha de platina (Pt) como eletrodo auxiliar. O pHmetro Micronal® (modelo B474) foi usado para medir o pH das soluções. O banho ultrassônico (Quimis®, modelo Q335D) foi empregado na limpeza do ECV e na homogeneização do compósito modificador. A chapa com agitação magnética (Warmnest®, modelo 78HW-1) e barra magnética foram usadas para regenerar a superfície eletródica entre as medidas eletroquímicas. O microscópio QuantaTM FEG-450 foi utilizado na caracterização morfológica da superfície eletródica por microscopia eletrônica de varredura com canhão de emissão de campo (MEVFEG). O espectrofotômetro Lambda 25 (PerkinElmer Inc.) com célula de quartzo de comprimento óptico igual a 1 cm, foi empregado nas medidas de espectroscopia de absorção molecular na região do ultravioleta e do visível (UV-Vis). Síntese do Zn2SnO4 O Zn2SnO4 foi sintetizado pelo método hidrotérmico em meio alcalino. Sucintamente, a síntese partiu da mistura de cloreto de estanho di-hidratado (SnCl2.2H2O) com acetado de zinco dihidratado (Zn(CH3OO)2.2H2O) na proporção molar de 1:2. Após agitação durante 10 min, o pH foi ajustado adicionando 0,75 g de NaOH, e a solução foi deixada em repouso durante 15 min. A solução foi então aquecida em autoclave a 200 ºC por 22 h. Após o resfriamento da autoclave, o produto reacional foi centrifugado e o precipitado resultante foi lavado diversas vezes com água deionizada e etanol, a fim de remover quaisquer íons remanescentes. Finalmente, a amostra foi seca em uma estufa a 80 ºC por 12 h e armazenada em um frasco adequado.31 Preparo do sensor As suspensões individuais de OGr, Zn2SnO4 e OGr-Zn2SnO4 (1:1) foram preparadas de modo a obter 1 mg mL-1 em meio de dimetilformamida (DMF) e Nafion® 0,5%. Todas as suspensões foram homogeneizadas em banho ultrassônico durante 60 min. Antes de receber a modificação, o ECV foi polido com pasta de diamante de 3 µm (Arotec®) e sonicado durante 3 min com etanol e água ultrapura, simultaneamente, a suspensão foi homogeneizada em banho ultrassônico durante 10 min. Por fim, o ECV foi modificado utilizando uma alíquota de 1,5 µL e o solvente evaporado em uma estufa a ± 60 ºC por 15 min. Experimentos eletroquímicos Os experimentos eletroquímicos foram realizados a 25 ºC usando 10 mL de eletrólito de suporte. A sondagem do comportamento eletroquímico do PMZ sobre as superfícies sensoras foi realizada com voltametria cíclica (VC) no intervalo de potencial de −0,3 a 1,1 V e velocidade de varredura (v) igual a 50 mV s-1, em meio à solução tampão BR pH 5,0. Para estudar o processo de transferência de carga na superfície eletródica, os ensaios de espectroscopia de impedância eletroquímica (EIE) foram realizados em meio à solução de K4[Fe(CN)6]/K3[Fe(CN)6] (1:1) 1,0 × 10-3 mol L-1 em KCl 0,1 mol L-1 com frequência variando de 60 kHz a 100 mHz e amplitude de 5 mV. As otimizações experimentais realizadas por VOQ foram avaliadas em diferentes pHs (3,0 a 11,0) e soluções tampões (BR, biftalato de potássio, Mcllvaine e Sörensen). Os parâmetros voltamétricos foram analisados em condições otimizadas de pH, com variações de f (frequência, 10 a 125 s-1), a (amplitude, 10 a 50 mV) e ΔEs (incremento de potencial, 1 a 5 mV). A superfície do ECV/OGrZn2SnO4 foi limpa por agitação magnética durante 60 s, entre cada medição. Os limites de detecção e quantificação (LD e LQ), precisão (repetibilidade e precisão intermediária), porcentagem de recuperação (%REC), desvio padrão relativo (%DPR) e exatidão (%BIAS) foram calculados conforme descrito na literatura.32,33 Coleta e preparação da amostra A eficiência da metodologia desenvolvida foi avaliada por comparação dos dados de recuperação obtidos por VOQ com a metodologia oficial preconizada pela Farmacopeia Brasileira,34 espectroscopia de absorção molecular na região do ultravioleta e do visível (UV-Vis) usando como amostra o fármaco de referência da PMZ. Utilizou-se o método de amostragem simples e pontual; ou seja, realizou-se de maneira aleatória num dado momento uma coleta única em local específico do comércio local, de uma caixa da formulação farmacêutica Fenergan® 25 mg (em comprimidos) de um lote específico. Uma massa de cinco comprimidos foi pulverizada com auxílio de almofariz e pistilo, e desta, extraída uma determinada massa específica que foi devidamente diluída em etanol 96%, e logo após sonicada durante 10 min, a fim de obter-se uma solução estoque de PMZ 1 × 10-3 mol L-1; sendo por fim armazenada em frasco adequado e ao abrigo da luz. Construção das curvas analíticas Após a otimização dos parâmetros da VOQ (f,a e ΔEs), foram construídas as curvas analíticas utilizando o eletrólito de suporte otimizado e o sensor proposto ECV/OGr-Zn2SnO4, por meio do método de padrão externo. Nesse procedimento, foram adicionadas alíquotas da solução estoque padrão de PMZ (de concentração conhecida) à célula eletroquímica contendo o eletrólito de suporte, e, imediatamente após cada adição, as medidas voltamétricas foram realizadas. Entre uma medida e outra realizou-se o processo de limpeza do ECV/OGr-Zn2SnO4 usando agitação magnética por 60 s no próprio eletrólito de suporte. Em seguida, estabeleceu-se a correlação matemática entre a corrente de pico (Ip) e concentração de prometazina [PMZ]. As medidas voltamétricas foram realizadas em triplicata para cada ponto da curva, com margem de erro ≤ 5%, sendo construídas três curvas analíticas, que permitiram posteriormente a determinação da curva analítica média.
RESULTADOS E DISCUSSÃO Caracterização morfológica do sensor eletroquímico As imagens de MEV-FEG (Figuras 1a-1d) foram utilizadas para observar a morfologia das superfícies ECV/Zn2SnO4, ECV/OGr e ECV/OGr-Zn2SnO4. Todos os filmes modificadores analisados se mostraram capazes de recobrir a superfície do ECV. A superfície ECV/OGr (Figura 1a) exibiu estruturas compactadas com aspecto de folhas enrugadas, o que proporcionam um aumento da área superficial e são provavelmente explicadas pelas interações π-π presentes no OGr.35,36 Em contraste, na superfície ECV/Zn2SnO4 (Figura 1b) foram observadas majoritariamente estruturas de cristais de forma cúbica isolados, característicos do Zn2SnO4.24 As imagens para o ECV/OGr-Zn2SnO4 (Figuras 1c e 1d) mostram a agregação entre os componentes do compósito e evidenciam uma interação entre as espécies da suspensão.
Caracterização eletroquímica do sensor A resistência à transferência de carga (Rtc) dos sensores ECV, ECV/Zn2SnO4, ECV/OGr e ECV/OGr-Zn2SnO4 foi avaliada por meio de EIE em K4[Fe(CN)6]:K3[Fe(CN)6] 1 × 10-3 mol L-1 (1:1) e KCl 0,1 mol L-1, como mostrado no diagrama de Nyquist da Figura 2a. O tamanho do semicírculo observado na EIE correlaciona-se diretamente com a medição da Rtc, o que significa que um semicírculo maior indica maior resistência à transferência de elétrons.37
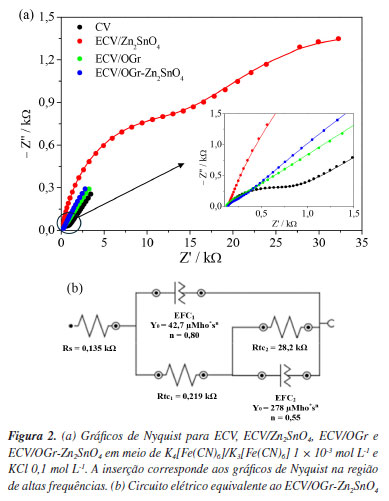
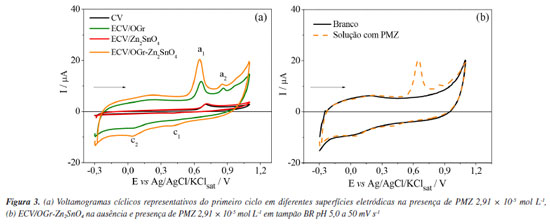
O diagrama do ECV mostrou a presença de um semicírculo na faixa de alta frequência com valor de Rtc igual a 0,713 kΩ, seguida da linha de difusão de Warburg, que é tipicamente caracterizada por um ângulo de fase de 45º após um semicírculo e representa a difusão semi-infinita.38 O ECV/Zn2SnO4 exibiu dois semicírculos distintos com valores de Rtc iguais a 16,1 e 41,9 kΩ. Notavelmente, não apresentou a linha de difusão de Warburg. Estudos anteriores31 relatam processos semelhantes quando analisam óxidos de estanho. Porém, não há consenso se esse perfil provém da rápida recombinação de óxidos na superfície do eletrodo ou da formação da camada de passivação. Isso sugere que a dinâmica na interface do ECV/Zn2SnO4 é complexa. Esse fator, associado aos altos valores de Rtc obtidos, indica que a utilização exclusiva de Zn2SnO4 como agente modificador não é a ideal. A EIE fornece não apenas os valores de Rtc, mas também informações sobre a resistência eletrolítica ou resistência à solução (Rs) e o elemento de fase constante (EFC).37 Ao analisar os ECV/OGr e ECV/OGr-Zn2SnO4, espectros semelhantes foram observados, com a presença de um semicírculo com característica capacitiva. Os circuitos correspondentes a esses diagramas consistem em Rs em série com Rtc1, que está em paralelo com o EFC1, conectados em série com EFC2. O valor da Rtc1 foi igual à 0,223 kΩ para o ECV/OGr; e 0,219 kΩ para o ECV/OGr-Zn2SnO4. Ambos EFC2 demonstraram valores de n (número de elétrons envolvidos na reação) próximos a 0,5, significando que o sistema se aproxima a difusão semi-infinita de Warburg.38,39 A Figura 2b apresenta o circuito equivalente ao ECV/OGr-Zn2SnO4. Considerando que o ECV/OGr-Zn2SnO4 registrou o menor valor de Rtc, o processo de transferência de elétrons é mais eficiente em sua superfície do que nas outras composições, indicando um sinergismo entre as espécies envolvidas na modificação. É importante destacar que, embora o Nafion® auxilie na agregação dos compostos do sensor, ele também promove relativa dificuldade no processo de transferência de carga na superfície eletrodo/solução (K4[Fe(CN)6]/K3[Fe(CN)6]). Por ser um polímero carregado negativamente, uma repulsão eletrostática causada por cargas semelhantes aumenta os valores de Rtc.31,40 Comportamento eletroquímico do PMZ sob diferentes sensores O comportamento eletroquímico do PMZ 2,91 × 10-5 mol L-1 foi estudado nas superfícies sensoras ECV, ECV/Zn2SnO4, ECV/OGr e ECV/OGr-Zn2SnO4 (Figura 3a), utilizando a técnica de VC no intervalo de potencial de −0,3 a 1,1 V. No ECV, a eletroxidação do PMZ resultou em um único processo anódico em 0,70 V, gerando uma corrente de pico de 1,77 µA. Este processo indica a remoção de dois elétrons, levando à formação do íon fenazotiazônio, facilitado por um radical catiônico intermediário. Ao reverter o ciclo, foi observado um pico catódico em 0,41 V, demonstrando a quase reversibilidade redox do intermediário.30,41 Processos eletroquímicos semelhantes foram observados para ECV/Zn2SnO4, com processo anódico em 0,71 V e corrente de pico de 1,57 µA, além de pico catódico idêntico ao do ECV.
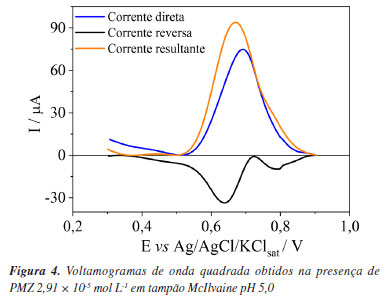
Para o ECV/OGr, foram observados dois processos anódicos distintos. O primeiro processo redox, relacionado a eletroxidação do PMZ, ocorreu no potencial de 0,66 V e apresentou corrente de pico de 6,03 µA (a1), mostrando um aumento de corrente de 3,4 vezes maior que no ECV. Esse aumento pode ser relacionado à estrutura do OGr, que proporciona maior área superficial, facilitando a transferência de elétrons.42 O segundo processo anódico (a2) está possivelmente associado à formação da estrutura de sulfóxido dioxigenada de prometazina.30 Além disso, um segundo processo catódico (c2) foi observado, sendo atribuído a uma interação entre a superfície do eletrodo e o eletrólito de suporte, pois também esteve presente na leitura do branco (Figura 3b). Ademais, processos semelhantes foram observados no ECV/OGr-Zn2SnO4, mas com um aumento significativo no sinal, sendo o processo principal da oxidação do PMZ detectado em 0,65 V e 12,9 µA (a1), confirmando o efeito sinérgico do compósito OGr-Zn2SnO4. Um dos principais indicadores de atividade eletrocatalítica em sistemas eletroquímicos é a mudança no potencial de pico observada durante a oxidação ou redução de um analito. Nos dados apresentados, observou-se que, ao utilizar o eletrodo modificado (ECV/OGr-Zn2SnO4), houve redução no valor do potencial de pico para a oxidação do PMZ em comparação aos demais eletrodos. Essa antecipação do potencial de pico indica que a reação eletroquímica ocorreu de forma mais eficiente devido ao efeito eletrocatalítico do compósito (OGr-Zn2SnO4). O mecanismo proposto para o comportamento redox do PMZ, envolve a formação de um radical catiônico, seguido pela geração do íon fenazotiazônio, que é posteriormente oxidado em sulfóxido e disulfóxido de prometazina, conforme relatado anteriormente na literatura.30,41,43 Estudos de otimização do pH, eletrólito de suporte e parâmetros da VOQ Condições experimentais como pH, eletrólito de suporte e os parâmetros voltamétricos da VOQ foram otimizados com o intuito de maximizar o sinal analítico e assegurar um sistema com elevada sensibilidade e condições de reprodutibilidade. A influência do pH no processo de oxidação da PMZ (2,91 × 10-5 mol L-1) sob ECV/OGrZn2SnO4 foi avaliada em meio a tampão BR na faixa de pH de 3,0 a 11,0 por VOQ com f = 80 s-1, a = 50 mV e ΔEs = 2 mV. A relação entre potencial de pico (Ep) e corrente de pico (Ip) não apresentou linearidade e os valores obtidos em meio básico não apresentaram reprodutibilidade das medidas (%DPR ≥ 5). Os resultados obtidos por meio do estudo de otimização do pH do meio encontram-se ilustrados na Figura 1S, disponível no Material Suplementar. Como a reprodutibilidade das medidas voltamétricas de um sistema é essencial para o desenvolvimento de uma metodologia analítica, optou-se pelo pH 5,0 (Ip = 35,6 µA e %DPR = 2,81) como o valor de pH otimizado, por apresentar o maior valor de Ip com %DPR ≤ 5, corroborando com estudos anteriores44,45 que demonstraram que em média a eletroxidação do PMZ é favorecida em ambientes ácidos. A influência da solução eletrolítica de suporte foi avaliada testando os tampões BR, biftalato de potássio, Mcllvaine e Sörensen, todos em pH 5,0. Os dados obtidos mostraram que a resposta máxima da corrente de pico foi alcançada no tampão McIlvaine (Ip = 93,9 µA e %DPR = 2,91). Usando este tampão, o pH foi variado entre 3,0 e 7,0. Os dados obtidos por meio do estudo de otimização do eletrólito de suporte encontram-se ilustrados na Figura 2S, disponível no Material Suplementar. Os resultados confirmaram o tampão Mcllvaine pH 5,0 como otimizado, por apresentar maior sensibilidade, mantendo-se com os maiores valores de Ip. Além disso, o perfil voltamétrico obtido nessas condições (Figura 4), mostrou uma assimetria entre a corrente direta e a reversa, confirmando a quase reversibilidade do processo observado na VC.46
O estudo de otimização dos parâmetros da VOQ mostrou que o aumento da f teve um impacto positivo no sinal, com uma dependência linear entre 10 e 80 s-1, conforme: Ip / µA = (1,19 × 10-5 ± 9,59 × 10-7) + (9,49 × 10-7 ± 2,56 × 10-8) f / s-1, com R2 = 0,995. A variação da a apresentou uma relação linear com Ip entre 10 e 50 mV, conforme: Ip / µA = (3,54 × 10-6 ± 1,31 × 10-6) + (1,62 × 10-6 ± 5,91 × 10-8) a / mV, com R2 = 0,995. A variação do ΔEs foi realizada no intervalo de 1 a 5 mV, mas não houve uma relação linear desse parâmetro com a Ip. O valor de f = 80 s-1 foi definido como valor otimizado por representar o limite superior da faixa linear, onde o sinal de Ip é amplificado sem a introdução de ruídos significativos. Segundo a teoria da VOQ, o valor teórico otimizado de a para serem realizados os testes experimentais segue a relação: 50/n, sendo n o número de elétrons envolvidos na reação, logo o valor ideal é igual a 25 mV.47,48 Por não apresentar linearidade entre ΔEs e Ip, manteve-se o valor experimental de ΔEs = 2 mV, como otimizado. Portanto, os valores otimizados adotados para as aplicações eletroanalíticas foram f = 80 s-1, a = 25 mV e ΔEs = 2 mV. Efeito da velocidade de varredura Experimentos de VC foram realizados para avaliar a influência da velocidade de varredura entre 10 e 200 mV s-1 na presença de PMZ 2,91 × 10-5 mol L-1 em tampão McIlvaine pH 5,0 usando ECV/OGrZn2SnO4 entre −0,3 e 1,5 V. O comportamento eletroquímico obtido é mostrado na Figura 5. A partir dos perfis obtidos, tornou-se evidente a presença do processo anódico referente a etapa determinante no processo de oxidação do PMZ, corroborando com os dados observados nos experimentos de VC anteriormente apresentados, sobre o comportamento eletroquímico da PMZ.
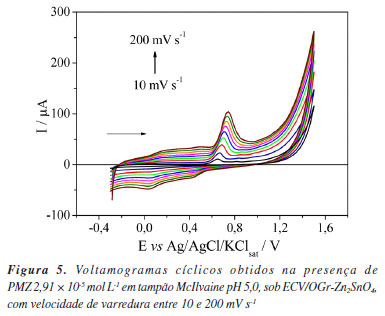
O aumento da velocidade de varredura promoveu tanto o aumento dos valores de Ip quanto o deslocamento do Ep para valores mais positivos. Uma relação linear entre Ip e a raiz quadrada da velocidade de varredura (v1/2) foi obtida conforme a equação: Ip / µA = (−1,13 × 10-5 ± 9,45 × 10-7) + (1,71 × 10-4 ± 2,97 × 10-6) v1/2 / V s-1 com R2 = 0,998, indicando que o processo de oxidação do PMZ é principalmente controlado por difusão.47 A relação linear entre log Ip e log v, também foi estabelecida com a equação: log Ip / µA = (−3,66 ± 0,01) + (0,72 ± 0,01) log v / V s-1 com R2 = 0,999. O coeficiente angular obtido igual a 0,72 indica que o processo de oxidação possui controle com caráter misto (difusional e adsortivo). Contudo, sua inclinação (mais próxima de 0,5) indica que o controle difusional é o principal regente.49 O número de elétrons envolvidos na oxidação da PMZ foi estimado pela relação de Ep e log v, expressa pela equação: Ep / V = (0,786 ± 5,09 × 10-3) + (0,07 ± 4,22 × 10-3) log v / V s-1 com R2 = 0,974. Por meio da seguinte relação matemática:49 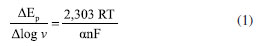 em que R é a constante universal dos gases (8,314 J K-1 mol-1), T é a temperatura (298,15 K), F é a constante de Faraday (96480 C), α é o coeficiente de transferência de elétrons e n é o número de elétrons transferidos. A partir da equação, foi obtido o valor de αn = 0,845. O valor de α igual a 0,5 é empregado para sistemas com moléculas orgânicas em meio aquoso;31,50 consequentemente, o número de elétrons envolvidos na etapa determinante é igual a 2, corroborando com o mecanismo de oxidação proposto. Curvas analíticas Sob as condições otimizadas, curvas analíticas de PMZ foram construídas usando ECV/OGr-Zn2SnO4 em tampão McIlvaine pH 5,0 com f = 80 s-1, a = 25 mV e ΔEs = 2 mV. Os resultados experimentais demostraram que a superfície do ECV/OGr-Zn2SnO4 manteve-se estável, garantindo uma sequência de medidas voltamétricas superior a 27 leituras (9 pontos de cada curva analítica, em triplicata), mantendo %DPR inferior a 5%. A Figura 6 apresenta os perfis voltamétricos de VOQ obtidos, com a inserção de uma curva analítica média com barra de erro, incluindo as curvas dos intervalos de confiança e de predição, ao nível de confiança de 95%. Uma relação linear entre Ip e concentração de PMZ foi obtida de 1,48 × 10-7 a 6,48 × 10-6 mol L-1: Ip / µA = (1,21 × 10-7 ± 6,16 × 10-9) + (2,0383 ± 0,0303) [PMZ] / mol L-1, com R2 = 0,998 e n = 9. Os valores de LD e LQ obtidos pela técnica de VOQ (1,24 × 10-8 e 3,76 × 10-8 mol L-1, respectivamente) foram inferiores aos calculados pela técnica de UV-Vis (2,04 × 10-8 e 6,718 × 10-8 mol L-1, respectivamente), demonstrando que o sensor desenvolvido (ECV/OGr-Zn2SnO4) apresentou maior eficiência na determinação e quantificação da PMZ ante a metodologia oficial preconizada pela Agência Nacional de Vigilância Sanitária.33 A Tabela 1 apresenta uma comparação detalhada da faixa linear, R2, ICa, ICb, Sa, LD e LQ, para ambas as técnicas (VOQ e UV-Vis); tendo ainda sido observada uma diferença significativa ao nível de 5% (valor p < 0,05) em todos os valores dos parâmetros obtidos pelas mesmas.
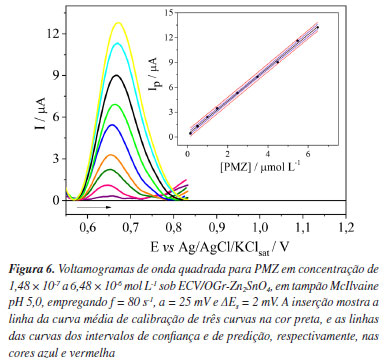
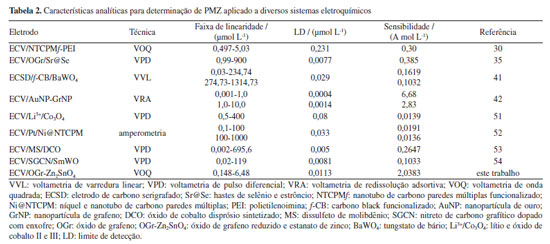
A precisão da metodologia foi averiguada por meio da precisão intermediária (inter-day, n = 7) e repetibilidade (intra-day, n = 12), ambos os testes apresentaram valores de %DPR inferior a 2,0%, demostrando a eficiência e a confiabilidade na determinação de PMZ. O desempenho analítico do sensor desenvolvido foi comparado com outros artigos publicados, conforme exposto na Tabela 2, no qual o ECV/OGr-Zn2SnO4 mostrou uma das maiores sensibilidades (2,0383 A mol L-1). Ao combinar Zn2SnO4 com OGr, não apenas a sensibilidade do sensor é aprimorada, mas também surge um novo método promissor para detecção de fármacos, usando-se combinações de óxidos nanometálicos com materiais carbonáceos como modificadores de sensores.
Efeito de interferentes A influência de possíveis interferências para a detecção de PMZ usando ECV/OGr-Zn2SnO4 foi realizada adicionando várias espécies químicas em quantidades fixas de PMZ na proporção de 10:1 ([interferente]:[PMZ]). Algumas espécies que poderiam estar presentes na formulação farmacêutica, como lactose, amido solúvel e dióxido de titânio, e alguns íons comuns como K+, Na+, Fe2+, Mg2+, Ca2+, Cl−, NO3− e SO42− foram analisadas (Figura 7) e demostraram interferências inferiores a ± 5%.
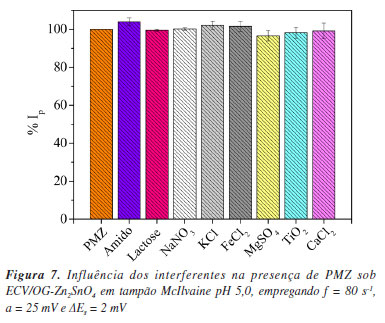
A partir dos valores de %Ip, o teste t foi aplicado para cada interferente individualmente, obtendo-se valores de tcalculado inferiores ao valor de tcrítico (4,30)55 para um nível de significância de 95%, validando a hipótese nula de que não há variação significativa entre os valores na ausência e na presença dos interferentes. Consequentemente, destaca-se que o sensor desenvolvido possui capacidade de resistência à interferência. Desempenho eletroanalítico em amostras complexas O ECV/OGr-Zn2SnO4 foi aplicado em amostras do fármaco Fenergan®. Estudos de recuperação foram realizados em seis pontos diferentes dentro da faixa de linearidade da curva de calibração, e uma curva média de recuperação foi obtida conforme a equação: Ip / µA = (5,66 × 10-8 ± 3,12 × 10-8) + (2,0016 ± 0,0135) [PMZ] / mol L-1, com R2 = 0,999. Os valores de %REC, %DPR e %BIAS foram calculados e estão dispostos na Tabela 3.
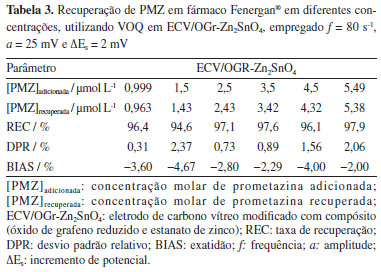
A fim de determinar se havia ocorrência de efeito matriz, as inclinações da curva de recuperação e da curva de calibração foram comparadas, considerando os mesmos pontos de [PMZ]. As inclinações obtidas foram de (2,0383 ± 0,0303) e (2,0016 ± 0,0135) µA L mol1, respectivamente, evidenciando o paralelismo entre as curvas e, portanto, a ausência de efeito matriz.33 Para confirmar esta observação, foram aplicados os testes t e F a cada uma das curvas, obtendo-se os valores t = 2,49 (inferior ao valor de tcrítico de 4,30) e F = 0,81 (inferior ao valor de Fcrítico de 9,55). Dessa forma, a metodologia sugerida neste trabalho é capaz de detectar PMZ em amostras de formulação farmacêutica sem a necessidade de tratamento prévio. Conforme declarado pela Association of Official Analytical Chemists (AOAC),32 a %REC de analitos nas concentrações associadas a este estudo se encontra dentro da faixa aceitável de 80 a 110%. Portanto, pode-se concluir que o método analítico proposto obteve %REC média satisfatória de 96,62%, ao mesmo tempo em que apresentou elevada precisão (%DPR médio = 1,32%) e exatidão (%BIAS = −3,23%). Os resultados obtidos por VOQ foram comparados aos obtidos por UV-Vis (Tabelas 4 e 5), método oficial adotado pela ANVISA,33 por meio da Farmacopeia Brasileira,34 para a determinação de PMZ. Os resultados de ambos os métodos foram avaliados através dos testes t (igual a 0,99) e F (igual a 1,05), que se mostraram inferiores aos valores críticos de tcrítico = 4,30 e Fcrítico = 7,71, indicando que os dados obtidos pelo sensor recém-desenvolvido correspondem aos do método padrão usado pela Farmacopeia Brasileira, demonstrando que ambas as técnicas apresentam precisão semelhante e confirmando a eficácia da metodologia criada para medir PMZ em matrizes complexas.
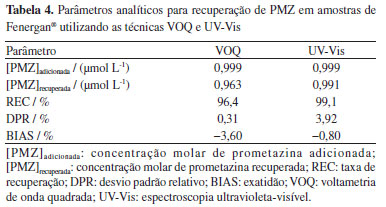
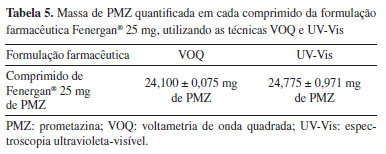
É importante destacar que, embora a %REC para o método UVVis seja superior, ambos os métodos estão dentro dos limites aceitáveis estabelecidos pela ANVISA.33 Além disso, a precisão e exatidão de ambos os métodos são evidenciadas pelos valores de %DPR e %BIAS, que se mantiveram na faixa aceitável de ± 5%.
CONCLUSÕES O sensor composto por carbono vítreo modificado com uma suspensão de óxido de grafeno reduzido e estanato de zinco mostrou-se eficiente para a detecção de PMZ. As análises voltamétricas revelaram que o processo de oxidação do PMZ sobre a superfície do ECV/OGr-Zn2SnO4 é quase reversível, controlado por difusão-adsorção e envolve dois elétrons. Além disso, o aumento da intensidade das respostas eletroquímicas obtidas comprovou o sinergismo entre as espécies do composto. O sensor apresentou ampla linearidade, sensibilidade, exatidão e precisão, com limites de detecção e quantificação superiores aos do método UV-Vis (método oficial adotado pela Farmacopeia Brasileira). A metodologia eletroanalítica desenvolvida foi eficaz na análise de PMZ em formulações farmacêuticas comerciais, com uma taxa de recuperação média de 96,62%. Assim, o sensor ECV/OGr-Zn2SnO4 representa uma excelente alternativa para a análise de PMZ, oferecendo uma abordagem eficiente sem necessidade de pré-tratamentos e com redução de custos operacionais.
MATERIAL SUPLEMENTAR O material suplementar deste trabalho encontra-se disponível no site http://quimicanova.sbq.org.br/, em arquivo PDF, com acesso gratuito.
AGRADECIMENTOS Este estudo foi financiado em parte pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES), código financeiro 001 (PROEX 23038.000509/2020-82). Os autores agradecem o apoio financeiro dado pelas seguintes agências financiadoras brasileiras: Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico (FUNCAP). P. B. A. F. agradece ao CNPq (proc. 308452/2022-4) e à FUNCAP (proc. PNE 0112-00048.01.00/16). F. W. P. R. reconhece o financiamento fornecido pela FUNCAP-BPI (proc. BP5-0197-00017.01.00/22). P. L. N. agradece ao CNPq (proc. 302825/20223). A. N. C. agradece o financiamento fornecido pelo CNPq (proc. 305136/2018-6 e proc. 305103/2022-9). Os autores gostariam de agradecer à Central Analítica-UFC/CT-INFRA/MCTI-SISANO/Pró-Equipamentos CAPES pelo apoio.
REFERÊNCIAS 1. International Union of Pure and Applied Chemistry, https://iupac.org/what-we-do/nomenclature/, acessado em Maio 2025. 2. Alyami, H. S.; Ibrahim, M. A.; Alyami, M. H.; Dahmash, E. Z.; Almeanazel, O. T.; Algahtani, T. S.; Alanazi, F.; Alshora, D. H.; Saudi Pharm. J. 2021, 29, 478. [Crossref] 3. Samardžić, M.; Persić, M.; Széchenyi, A.; Jozanović, M.; Pukles, I.; Budetić, M.; Sensors 2023, 23, 2641. [Crossref] 4. Cantisani, C.; Ricci, S.; Grieco, T.; Paolino, G.; Faina, V.; Silvestri, E.; Calvieri, S.; BioMed Res. Int. 2013, 2013, 1. [Crossref] 5. Ignoto, S.; Pecoraro, R.; Scalisi, E. M.; Buttigè, S. E.; Contino, M.; Ferruggia, G.; Brundo, M. V.; ACS Omega 2022, 7, 39619. [Crossref] 6. Wu, R.; Sin, Y. Y.; Cai, L.; Wang, Y.; Hu, M.; Liu, X.; Leung, K. M. Y.; Environ. Sci. Technol. 2024, 58, 5512. [Crossref] 7. Wen, D.; Shi, R.; He, H.; Chen, R.; Zhang, Y.; Liu, R.; Chen, H.; Foods 2023, 12, 2180. [Crossref] 8. Raja, D. A.; Shah, M. R.; Malik, M. I.; Anal. Chim. Acta 2022, 1223, 340216. [Crossref] 9. Kalambate, P. K.; Rao, Z.; Wu, J.; Shen, Y.; Boddula, R.; Huang, Y.; Biosens. Bioelectron. 2020, 163, 112270. [Crossref] 10. Yáñez-Sedeño, P.; Campuzano, S.; Pingarrón, J. M.; Curr. Opin. Green Sustainable Chem. 2019, 19, 1. [Crossref] 11. Maduraiveeran, G.; Sasidharan, M.; Ganesan, V.; Biosens. Bioelectron. 2018, 103, 113. [Crossref] 12. Dong, X.; Zhang, C.; Du, X.; Zhang, Z.; Nanomaterials 2022, 12, 1913. [Crossref] 13. Paut, A.; Prkić, A.; Mitar, I.; Guć, L.; Kem. Ind. 2023, 72, 5. [Crossref] 14. Manikanta, P.; Mounesh; Nikam, R. R.; Mohanty, J.; Balakrishna, R. G.; Sandeep, S.; Nagaraja, B. M.; Langmuir 2023, 39, 11099. [Crossref] 15. Sebastian, N.; Yu, W. C.; Hu, Y. C.; Balram, D.; Yu, Y. H.; J. Alloys Compd. 2022, 890, 161768. [Crossref] 16. Juang, R. S.; Hsieh, C. T.; Lin, T. A.; J. Mol. Liq. 2024, 399, 124460. [Crossref] 17. Zhang, H.; Cheng, L.; Shang, H.; Zhang, W.; Zhang, A.; Russ. J. Electrochem. 2021, 57, 872. [Crossref] 18. Shi, S.; Zhou, C.; Wei, Y.; Chen, A.; Tang, N.; He, Q.; Deng, P.; Microchem. J. 2023, 194, 109310. [Crossref] 19. Beitollahi, H.; Nejad, F. G.; Electroanalysis 2016, 28, 2237. [Crossref] 20. Lai, W.; Reddy, O. S.; Zhang, H.; Zhang, D.; Wong, W.; ChemMedChem 2022, 17, e202200111. [Crossref] 21. Papageorgiou, D. G.; Kinloch, I. A.; Young, R. J.; Prog. Mater. Sci. 2017, 90, 75. [Crossref] 22. Smith, A. T.; LaChance, A. M.; Zeng, S.; Liu, B.; Sun, L.; Nano Mater. Sci. 2019, 1, 31. [Crossref] 23. Jiříčková, A.; Jankovský, O.; Sofer, Z.; Sedmidubský, D.; Materials 2022, 15, 920. [Crossref] 24. Baruah, S.; Dutta, J.; Sci. Technol. Adv. Mater. 2011, 12, 013004. [Crossref] 25. Ayesha, B.; Jabeen, U.; Naeem, A.; Kasi, P.; Malghani, M. N. K.; Khan, S. U.; Akhtar, J.; Aamir, M.; Results Chem. 2020, 2, 100023. [Crossref] 26. Sung, N. E.; Shin, H. J.; Chae, K. H.; Won, S. O.; Lee, I. J.; ACS Appl. Energy Mater. 2020, 3, 6056. [Crossref] 27. Kim, N.; Shim, J. H.; Jae, W.; Song, J.; Kim, J.; J. Alloys Compd. 2019, 786, 346. [Crossref] 28. Chen, Z. Y.; Jiang, D. P.; Zhang, S. H.; Wang, C.; Huang, H.; Zhang, L.; Ding, L. Y.; Wang, L. J.; Pan, G. B.; Chem. Phys. Lett. 2020, 741, 137067. [Crossref] 29. Wu, D.; Akhtar, A.; Molecules 2023, 28, 3230. [Crossref] 30. de Oliveira, R. C.; Sousa, C. P.; Morais, S.; de Lima-Neto, P.; Correia, A. N.; J. Electrochem. Soc. 2020, 167, 107506. [Crossref] 31. de Castro, J. S.; Chaves, A. V.; Fechine, P. B. A.; de Oliveira, R. C.; Ribeiro, F. W. P.; de Lima-Neto, P.; Abreu, D. S.; de Oliveira, C. L. C. G.; Correia, A. N.; J. Electrochem. Soc. 2024, 171, 017501. [Crossref] 32. Association of Official Analytical Collaboration International (AOAC); Appendix F: Guidelines for Standard Method Performance Requirements; AOAC: Rockville, Maryland, 2016. [Link] acessado em Maio 2025 33. Agência Nacional de Vigilância Sanitária (ANVISA); Resolução da Diretoria Colegiada (RDC) No. 166, de 24 de julho de 2017, Estabelece Critérios para a Validação de Métodos Analíticos e dá Outras Providências; Diário Oficial da União (DOU), Brasília, No. 141, de 25/07/2017. [Link] acessado em Maio 2025 34. Farmacopeia Brasileira, 4a ed.; Atheneu: São Paulo, 2002. 35. Hwa, K. Y.; Ganguly, A.; Santhan, A.; Sharma, T. S. K.; Mater. Today Chem. 2022, 23, 100654. [Crossref] 36. Borges, P.; Nossol, E.; J. Braz. Chem. Soc. 2021, 32, 1259. [Crossref] 37. Lasia, A.; Electrochemical Impedance Spectroscopy and its Applications, 1st ed.; Springer: New York, 2014. 38. Ribeiro, J.; Rev. Virtual Quim. 2020, 12, 1626. [Crossref] 39. Andrade Neto, D. M.; da Costa, L. S.; Sousa, C. P.; Becker, H.; Casciano, P. N. S.; Nascimento, H. O.; Bezerra Neto, J. R.; de LimaNeto, P.; Nascimento, R. F.; Guedes, J. A. C.; de Oliveira, R. C.; Zampieri, D.; Correia, A. N.; Fechine, P. B. A.; Electrochim. Acta 2022, 432, 141193. [Crossref] 40. Xu, Z.; Yuan, S.; An, L.; Shen, S.; Xu, Q.; Yan, X.; Zhang, J.; ACS Appl. Mater. Interfaces 2023, 15, 10735. [Crossref] 41. Muthukutty, B.; Vivekanandan, A. K.; Chen, S. M.; Sivakumar, M.; Chen, S. H.; Composites, Part B 2021, 215, 108789. [Crossref] 42. Promsuwan, K.; Kanatharana, P.; Thavarungkul, P.; Limbut, W.; Microchim. Acta 2020, 187, 646. [Crossref] 43. Blankert, B.; Hayen, H.; van Leeuwen, S. M.; Karst, U.; Bodoki, E.; Lotrean, S.; Sandulescu, R.; Diez, N. M.; Dominguez, O.; Arcos, J.; Kauffmann, J. M.; Electroanalysis 2005, 17, 1501. [Crossref] 44. Lopes, L. C.; Lima, D.; Hacke, A. C. M.; Schveigert, B. S.; Calaça, G. N.; Simas, F. F.; Pereira, R. P.; Iacomini, M.; Viana, A. G.; Pessôa, C. A.; Talanta 2021, 223, 121634. [Crossref] 45. Felix, F. S.; Ferreira, L. M. C.; Vieira, F.; Trindade, G. M.; Ferreira, V. S. S. A.; Angnes, L.; New J. Chem. 2015, 39, 696. [Crossref] 46. Xu, G.; O'Dea, J. J.; Osteryoung, J. G.; Dyes Pigm. 1996, 30, 201. [Crossref] 47. Bard, A. J.; Faulkner, L. R.; White, H. S.; Electrochemical Methodos: Fundamentals and Applications, 3rIV ed.; Wiley: Hoboken, 2022. 48. Gomes, R. N.; Bezerra-Neto, J. R.; Sousa, C. P.; Medeiros, S. L. S.; Becker, H.; Soares, J. E. S.; de Lima-Neto, P.; Correia, A. N.; Anal. Chim. Acta 2019, 1051, 49. [Crossref] 49. Gosser Junior, D. K.; Cyclic Voltammetry: Simulation and Analysis of Reaction Mechanisms, 1st ed.; UCH Publishers: New York, 1993. 50. Wang, J.; Analytical Electrochemistry, 2nIV ed.; Wiley: New York, 2001. 51. Tajik, S.; Nejad, F. G.; Beitollahi, H.; Russ. J. Electrochem. 2019, 55, 314. [Crossref] 52. Saraban, A.; Promsuwan, K.; Saichanapan, J.; Soleh, A.; Saisahas, K.; Samoson, K.; Wangchuk, S.; Sanjailuk, T.; Hasin, P.; Limbut, W.; J. Electrochem. Soc. 2023, 170, 067504. [Crossref] 53. Koventhan, C.; Pandiyan, R.; Chen, S. M.; Process Saf. Environ. Prot. 2023, 170, 1188. [Crossref] 54. Alagumalai, K.; Sivakumar, M.; Kim, S. C.; Lee, D.; Muthukutty, B.; Prakash, K.; Abdelghani, H. T. M.; Colloids Surf., A 2024, 694, 134107. [Crossref] 55. Miller, J. N.; Miller, J. C.; Miller, R. D.; Statistics and Chemometrics for Analytical Chemistry, 7th ed.; Pearson Education Limited: Londres, 2018.
Editor Associado responsável pelo artigo: Eduardo M. Richter |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access