Artigo
|
|
| Fenilpropanoides com ação anti-Trypanosoma cruzi isolados das folhas de Piper crassinervium (Piperaceae) Phenylpropanoids with anti-Trypanosoma cruzi action isolated from leaves of Piper crassinervium (Piperaceae) |
|
Nathalia F. QuintilianoI,II; Sávio R. SoaresII; Miriam UemiI; Guilherme M. AntarIII; Patricia SartorelliII; Andre G. TemponeIV; I. Centro de Ciências Naturais e Humanas, Universidade Federal do ABC, 09210-170 Santo André - SP, Brasil Recebido: 03/02/2025 *e-mail: joao.lago@ufabc.edu.br In the present work, the hexane extract from leaves of Piper crassinervium (Piperaceae) displayed activity against trypomastigotes of Trypanosoma cruzi (100% of parasite death at 200 μg mL-1) and was subjected to a bioactivity-guided fractionation. Using this approach, two free phenylpropanoids - methyl 2,3,4-trimethoxyphenylpropanoate (1) and methyl 3,4-dimethoxyphenylpropanoate (2) - one amide - 2α,3α-epoxy-1-piperidone (3) - and two phenylpropanoid imides - piplaroxide (4) and 4-hydroxy-3,5-dimethoxyphenylpropanoyl-2'α,3'α-epoxy-1'-piperidone (5) - were isolated. Compound 5 is an unreported metabolite and, except for 3, all other compounds are being described for the first time in P. crassinervium. Compounds 1-5 showed to be non-toxic against mammalian cells (NCTC 929 cells) with 50% cytotoxic concentration (CC50) > 200 μM and when evaluated against trypomastigotes, compounds 4 and 5 displayed higher potential with 50% effective concentration (EC50) values of 14.2 and 25.7 μM, respectively. Otherwise, compounds 1 and 2 exhibited moderate potential (EC50 = 45.7 and 38.3 μM) whereas 3 displayed reduced activity (EC50 = 97.9 μM). Altogether, these data suggested that the phenylpropanoid unit may play an important role in the potential against T. cruzi. INTRODUÇÃO O gênero Piper L. possui cerca de 2400 espécies, distribuídas nas regiões tropicais e subtropicais do planeta, apresentadas na forma de arbustos e pequenas árvores. No Brasil, há ocorrência de 299 espécies, sendo 194 delas endêmicas.1,2 Membros desse gênero apresentam destaque econômico sendo amplamente utilizados na indústria alimentícia, farmacêutica e agrícola.3-5 Além disso, diferentes espécies são utilizadas na medicina popular, como, por exemplo, P. guineense Schumach. & Thonn., empregada para o controle de tosse, bronquite, reumatismo, doenças venéreas dentre outras. Além dessa, a espécie P. longum L. é ministrada como antídoto para picadas de cobras e escorpiões enquanto P. aduncum L. é utilizada para o tratamento de desordens estomacais, tosse, febre e infecções além de atuar como inseticida.5-10 Fitoquimicamente, as espécies de Piper se destacam pela produção de ampla variedade de metabólitos tais como fenilpropanoides, amidas, alcaloides, lignanas/neolignanas, terpenos, esteroides, flavonoides, piperolídeos, kavapironas, cromenos e derivados de ácido benzoico,5,11 sendo grande parte desses compostos detentores de potentes atividades biológicas.6,11-15 Estudos anteriores com P. crassinervium Kunth resultaram no isolamento de amidas, cromenos, flavanonas, derivados prenilados de ácido benzoico e de hidroquinonas,16-20 os quais apresentaram atividade antifúngica,16-18 antioxidante19 e anti-Trypanosoma cruzi,20 o parasita causador da doença de Chagas. Apesar da doença de Chagas ser endêmica no Brasil, afetando diversas regiões e causando fortes impactos socioeconômicos, o tratamento por quimioterapia é realizado com um único fármaco disponível, o benznidazol.21 Considerando-se a elevada toxicidade e a reduzida efetividade desse medicamento, a busca de novos protótipos se faz necessária. Como parte dos nossos estudos visando a seleção de metabolitos com ação anti-T. cruzi,22,23 o extrato hexânico das folhas de P. crassinervium apresentou atividade contra formas tripomastigotas do parasita e foi submetido a um fracionamento biomonitorado. Desta forma foram isolados, como compostos ativos, dois fenilpropanoides livres (1 e 2), uma amida (3) e duas imidas (4 e 5) que, com exceção do composto 3, estão sendo descritas pela primeira vez em P. crassinervium.
PARTE EXPERIMENTAL Procedimentos gerais Sílica 60 (Merck, 230-400 mesh) ou Sephadex LH-20 (Amersham-Bioscience) foram utilizadas em procedimentos de cromatografia em coluna aberta enquanto que sílica 60 PF254 (Merck) foi utilizada nas análises em camada delgada (analítica e preparativa). Os espectros de massas (EM) de baixa resolução foram registrados em espectrômetro INCOS SO Finnigan - Mat (quadrupolo) via ionização por elétrons (IE) a 70 eV acoplado ao cromatógrafo 3400 Varian, equipado com coluna capilar DB-5 de 30 m de comprimento e 0,25 mm de diâmetro. Os espectros de massas de alta resolução (EMAR) foram registrados em espectrômetro Bruker Daltonics q-ToF Maxis, operando por ionização por electrospray, em modo positivo. Os espectros de ressonância magnética nuclear (RMN) foram registrados em espectrômetros Bruker DPX-300 (1H: 300 MHz e 13C: 75 MHz), Avance III (1H: 500 MHz e 13C: 125 MHz) e Varian Inova (1H: 500 MHz e 13C: 125 MHz). CDCl3 foi utilizado como solvente e tetrametilsilano (TMS) como referência interna. Material vegetal As folhas de P. crassinervium foram coletadas no Parque Estadual Fontes do Ipiranga em São Paulo/SP, Brasil, em abril de 2015 recebendo o código de coleta SISGEN A4123E4. Uma exsicata foi depositada no Herbário do Instituto de Biociências da Universidade de São Paulo (IB-USP) sob número SPF 218827. Extração e isolamento dos constituintes químicos As folhas de P. crassinervium, secadas e moídas (57 g), foram extraídas com hexano (3 × 100 mL) via maceração a frio. Após evaporação do solvente sob pressão reduzida, foram obtidos 2,8 g de extrato hexânico. Parte desse extrato (1,0 g) foi submetida a fracionamento cromatográfico em gel de sílica utilizando-se misturas de hexano/AcOEt (9:1, 8:2, 7:3, 6:4, 1:1, 4:6, 3:7, 2:8 e 1:9) fornecendo nove grupos (A-I). Após avaliação do potencial anti-T. cruzi in vitro, foi observado que os grupos C (39 mg), D (120 mg), G (55 mg) e H (63 mg) apresentavam atividade (100% de morte do parasita a 200 μg mL-1). O grupo C mostrou-se constituído por 4 na forma pura. Parte do grupo D (100 mg) foi purificado via CCDP (cromatografia de camada delgada preparativa) de gel de sílica, eluida com hexano/AcOEt (1:1), fornecendo 1 (28 mg) e 2 (48 mg). Parte dos grupos G (50 mg) e H (60 mg) foram purificados via coluna de gel de sílica utilizando-se misturas de hexano/AcOEt (7:3, 1:1 e 3:7) como eluentes, fornecendo 5 (18 mg) e 3 (8 mg), respectivamente. 4-Hidroxi-3,5-dimetoxifenilpropanoil-2'α,3'α-epoxi-1'-piperidona (5) Sólido branco amorfo. RMN 1H (500 MHz, CDCl3) δ 3,21 (m, H-8), 2,89 (dt, J 7,9 e 2,0 Hz, H-7), 6,47 (sl, H-2/H-6), 3,59 (d, J 4,0 Hz, H-2'), 3,71 (dd, J 4,0 e 3,1 Hz, H-3'), 2,43 (dl, J 15,2 Hz, H-4'a), 2,00 (ddd, J 15,5, 13,4 e 5,5 Hz, H-4'b), 3,19 (m, H-5'a), 4,33 (dddd, J 13,4, 5,5, 1,3 e 1,3 Hz, H-5'b), 3,87 (s, 3- e 5-OCH3); RMN 13C (125 MHz, CDCl3) δ 174,8 (C-9), 41,7 (C-8), 31,0 (C-7), 131,6 (C-1), 104,8 (C-2), 146,8 (C-3), 132,7 (C-4), 146,8 (C-5), 104,8 (C-6), 169,8 (C-1'), 52,4 (C-2'), 53,6 (C-3'), 23,7 (C-4'), 35,7 (C-5'), 56,2 (s, 3- e 5-OCH3). EMAR (ionização por electrospray, modo positivo) m/z 322,1287 [M + H]+ (calculado para C16H20NO6, 322,1291). Parasitas e manutenção de células de mamíferos Tripomastigotas de T. cruzi (cepa Y) foram mantidos em células de rim de macaco Rhesus (LLC-MK2, ATCC (American Type Culture Collection)), cultivadas em meio RPMI-1640 (Roswell Park Memorial Institute-1640) suplementado com 2% de SFB (soro fetal bovino) a 37 °C em uma incubadora umidificada com 5% de CO2. Macrófagos foram coletados da cavidade peritoneal de camundongos BALB/c lavando-os com meio RPMI-1640 suplementado com 10% de SFB e foram mantidos a 37 °C em uma incubadora umidificada com 5% de CO2. As células conjuntivas murinas (NCTC clone 929, ATCC) e LLC-MK2 (ATCC) foram mantidas em RPMI-1640 suplementado com 10% de SFB a 37 °C em uma atmosfera umidificada contendo 5% de CO2.24,25 Determinação do potencial frente as formas tripomastigotas de T. cruzi Tripomastigotas obtidos de culturas de LLC-MK2 foram contados em um hemocitômetro (Thermo Fisher Scientific) e semeados em microplacas a 1 × 106/poço. Para determinar os valores de concentração efetiva 50% (CE50), os compostos 1-5 e benznidazol (fármaco padrão) foram dissolvidos em DMSO (dimetilsulfóxido), diluídos em meio RPMI-1640 e mantidos por 24 h a 37 °C em uma incubadora umidificada com 5% de CO2. A viabilidade dos tripomastigotas foi verificada pelo ensaio de resazurina (Alamar Blue®) usando um leitor de microplacas (FilterMax F5 Multi-Mode Microplate Reader) com comprimentos de onda de excitação e emissão de 540 e 595 nm, respectivamente.25 Determinação da toxicidade frente a células de mamíferos Células NCTC-clone L929 (6 × 104 células/poço) foram semeadas e incubadas com os compostos 1-5 (1,56-200 μM) por 48 h a 37 °C em uma incubadora de 5% de CO2. A concentração citotóxica 50% (CC50) foi determinada pelo ensaio colorimétrico do MTT (3-(4,5-dimetil-2-tiazolyl)-2,5-difeniltetrazólio). A densidade óptica foi determinada no espectrofotômetro FilterMax F5 (Molecular Devices) a 570 nm. Os índices de seletividade (IS) para cada composto foram determinados usando a seguinte equação: CC50 contra células NCTC/CE50 contra parasitas.26 Análise estatística Os dados obtidos representam a média e o desvio padrão de amostras duplicadas de dois ensaios independentes. Os valores de CE50 e CC50 foram calculados usando curvas sigmoide dose-resposta no software GraphPad Prism 5.0 (GraphPad Software, EUA, 2008).
RESULTADOS E DISCUSSÃO O potencial anti-T. cruzi do extrato hexânico das folhas de P. crassinervium foi avaliado in vitro frente as formas tripomastigotas. Quanto testado a 200 μg mL-1, foi observada eliminação de 100% dos parasitas, indicativo de elevado potencial. O fracionamento cromatográfico biomonitorado desse extrato forneceu dois ésteres (1 e 2), uma amida (3) e duas imidas (4 e 5), como mostrado na Figura 1. O composto 5 é inédito e, com exceção de 3, todas as demais substâncias estão sendo descritas pela primeira vez em P. crassinervium.
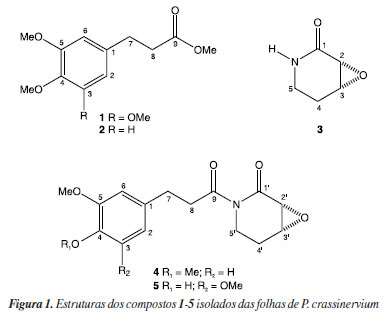
No espectro de RMN de 1H do composto 1 foi observado um simpleto em δ 6,39 (2H) referente aos hidrogênios H-2 e H-6, indicando um anel aromático 1,3,4,5-tetrassubstituido. Adicionalmente, dois tripletos em δ 2,87 (J 8,0 Hz) e 2,60 (J 8,0 Hz), atribuídos, respectivamente a H-7 e H-8, indicaram a presença de um derivado fenilpropanoídico. Três simpletos em δ 3,66 (3H), 3,79 (6H) e 3,81 (3H) foram atribuídos a hidrogênios de quatro grupos metoxílicos, incluindo um de éster metílico. O espectro de RMN de 13C mostrou quatro sinais atribuídos aos carbonos aromáticos C-1 a C-6 entre δ 105-153, à carbonila C-9 em δ 173,3 e aos carbonos metilênicos C-7 e C-8 em δ 35,8 e 31,2, respectivamente. Os sinais em δ 51,7, 56,0 e 60,8 foram atribuídos aos grupos metoxílicos, sendo o último indicativo de sistema impedido estericamente (4-OMe). Finalmente, o espectro de massas mostrou o pico relativo ao íon molecular em m/z 254 e fragmentações em m/z 239, 223 e 181 (ver Material Suplementar). Assim, a comparação dos dados espectroscópicos obtidos com aqueles descritos na literatura27 permitiu a identificação de 1 como 3,4,5-trimetoxifenilpropanoato de metila. O espectro de RMN de 1H de 2 se mostrou similar ao de 1, em especial na região alifática, sugerindo a ocorrência de outro derivado fenilpropanoídico. No entanto, na região dos hidrogênios aromáticos, foram observados sinais em δ 6,79 (d, J 8,6 Hz, H-3), 6,73 (d, J 2,0 Hz, H-6) e 6,72 (dd, J 8,6 e 2,0 Hz, H-2), indicando um anel aromático 1,3,4-trissubstituído. Os três simpletos em δ 3,68, 3,84 e 3,86, integrando para três hidrogênios cada, foram atribuídos aos grupos metoxílicos ligados a C-9, C-5 e C-4. O espectro de RMN de 13C mostrou, seis sinais referentes aos carbonos do anel aromático entre δ 111-149, confirmando o perfil observado via RMN de 1H. Finalmente, o espectro de massas mostrou o pico relativo ao íon molecular em m/z 224 além de fragmentações em m/z 209 e 151 (ver Material Suplementar). Desta forma, a comparação dos dados com aqueles descritos na literatura28 permitiu a identificação de 2 como 4,5-dimetoxifenilpropanoato de metila. O espectro de RMN de 1H de 3 mostrou, dentre outros, dois sinais de hidrogênios ligados a carbonos de epóxido em δ 3,61 (m, H-3) e em δ 3,34 (d, J 4,3 Hz, H-2), sendo o valor da constante de acoplamento de H-2 característico de configuração cis.29 O espectro de RMN de 13C mostrou cinco sinais, correspondentes a uma carbonila em δ 169,0 (C-1), dois carbonos oximetínicos em δ 53,1 (C-2) e em δ 50,7 (C-3) e dois carbonos metilênicos em δ 23,5 (C-4) e em δ 35,3 (C-5). A comparação dos dados com aqueles descritos na literatura18 permitiu a identificação de 3 como 2α,3α-epoxi-1-piperidona, descrito previamente em P. crassinervium. O espectro de RMN de 1H de 4 mostrou dois simpletos em δ 6,77 (H-2 e H-3) e em 6,76 (H-6), um multipleto em δ 3,21 (H-8) e um tripleto em δ 2,90 (J 7,6 Hz, H-7), similar ao observado para o composto 2. Neste espectro foram observados dois outros simpletos em δ 3,86 e 3,84, integrando para três hidrogênios cada, relativos a dois grupos metoxílicos ligados a anel aromático. Foram observados, de forma similar ao composto 3, sinais de hidrogênios ligados a carbonos de epóxido em δ 3,54 (d, J 4,0 Hz, H-2') e 3,66 (m, H-3'). Tal perfil permitiu sugerir que o composto 4 possui uma unidade fenilpropanoídica similar à de 2 ligada a amida 3. O espectro de RMN de 13C mostrou seis sinais referentes a carbonos aromáticos entre δ 111-149 (C-1 a C-6), a dois carbonos carbonílicos em δ 174,8 (C-9) e 169,6 (C-1'), a um grupo metilênico a-carbonílico em δ 41,3 (C-8), a um grupo benzílico em δ 30,4 (C-7) e a duas metoxilas em δ 55,8 e 55,9. Ao analisar os sinais remanescentes, foram observados quatro sinais em δ 52,3 (C-2'), 53,4 (C-3'), 23,8 (C-4') e em 35,6 (C-5'), confirmando a unidade 2α,3α-epoxi-1-piperidona (3). O espectro de massas de alta resolução 4 mostrou o íon [M + H]+ em m/z 306,1378, em conformidade com fórmula molecular C16H19NO5. Portanto, comparando os dados espectroscópicos obtidos com os encontrados na literatura30 permitiu a identificação de 4 como piplaróxido. O espectro de RMN de 1H de 5 mostrou um simpleto largo em δ 6,47 (2H), atribuído a H-2 e H-6, sugerindo um sistema aromático 1,3,4,5-tetrassubstituído, similar ao observado para 1. Tal perfil foi confirmado pela presença de sinais em δ 3,21 (m, H-8), 2,89 (dt, J 7,9 e 2,0 Hz, H-7) e 3,87 (s, 3- e 5-OMe). Além desses, foram observados sinais de hidrogênios ligados a carbonos de epóxido em δ 3,59 (d, J 4,0 Hz, H-2') e 3,71 (dd, J 4,0 e 3,1 Hz, H-3') sugerindo que, assim como o observado para 4, o composto 5 seja uma imida formada pela condensação de um derivado fenilpropanoídico com a amida 3. Assim como observado para 4, o espectro de RMN de 13C de 5 mostrou sinais atribuídos aos carbonos aromáticos C-1 a C-6 entre δ 105-147, aos carbonos carbonílicos C-9 e C-1" em δ 174,8 e 169,8, respectivamente, além daqueles atribuídos a δ 41,7 (C-8) e a 30,0 (C-7). Além desses, um sinal referente aos grupos metoxílicos em C-3/C-5, foi observado em δ 56,2. Ainda na região alifática, os sinais referentes aos carbonos da unidade 2α,3α-epoxi-1-piperidona foram observados em δ 52,4 (C-2'), 53,6 (C-3'), 35,7 (C-4') e 23,7 (C-5'), de forma similar ao composto 3. Finalmente, o espectro de massas de 5 mostrou o íon [M + H]+ em m/z 322,1287, em conformidade com fórmula molecular C16H19NO6. Portanto, a partir dos dados espectroscópicos e espectrométricos obtidos, foi possível a determinação estrutural de 5 como sendo 4-hidroxi-3,5-dimetoxifenilpropanoil-2'α,3'α-epoxi-1'-piperidona, inédito na literatura. Finalmente, a efetividade contra formas tripomastigotas de T. cruzi dos compostos 1-5, isolados de P. crassinervium, foi avaliada in vitro. Inicialmente, foi avaliada a citotoxicidade em células de mamífero NCTC (fibroblasto murino) e, posteriormente, foram determinados os valores de CE50 nos parasitas, possibilitando o cálculo dos índices de seletividade (IS). No que tange a toxicidade frente as células NCTC, todos os compostos testados se mostraram não citotóxicos na concentração máxima testada (CC50 > 200 μM), como observado na Tabela 1.
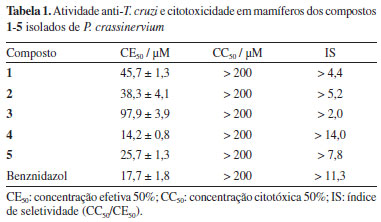
Frente aos tripomastigotas, os ésteres metílicos 1 e 2 mostraram valores de CE50 de 45,7 μM (IS > 4,4) e 38,3 μM (IS > 5,2), respectivamente, superiores ao determinado para o controle positivo benznidazol (CE50 = 17,7 μM e IS > 11,3). Por outro lado, o composto 4, oriundo da condensação de 2 e 3, apresentou valor de CE50 de 14,2 μM (IS > 14,0), similar ao observado para o benznidazol, inferior ao determinado para 2 e superior ao de 3, cujo valor de CE50 foi de 97,9 μM (IS > 2,0). Da mesma forma, o composto 5 apresentou atividade moderada frente aos tripomastigotas (CE50 = 25,7 μM, IS > 7,8), mas superior àquela observada para 1-3. Levando em conta tais resultados bem como as características estruturais de 1-5, é possível sugerir que a unidade fenilpropanoídica possa exercer um papel importante no que tange a atividade das imidas 4 e 5.
CONCLUSÃO O presente trabalho descreve o isolamento e a caracterização estrutural dois fenilpropanoides livres (1 e 2), uma amida (3) e duas imidas (4 e 5) do extrato hexânico das folhas de P. crassinervium. O composto 5 é inédito enquanto que, com exceção de 3, todos estão sendo descritos pela primeira vez na espécie em estudo. Os compostos 1-5 mostraram-se não tóxicos frente a células NCTC, porém, quando avaliados frente às formas tripomastigotas de T. cruzi, todos se mostraram ativos destacando-se 4 e 5, com maior potencial. Tais resultados sugerem que a unidade fenilpropanoídica pode desempenhar um papel importante na atividade contra o parasita. Assim, é possível inferir que novas moléculas similares a 4 e 5 possam ser planejadas, futuramente, visando a realização de estudos de relação estrutura/atividade frente ao T. cruzi.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho está disponível em http://quimicanova.sbq.org.br/, como arquivo em PDF e de livre acesso.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados estão disponíveis no texto. Em caso de dúvida ou necessidade de algum esclarecimento adicional, entrar em contato com o autor de correspondência.
AGRADECIMENTOS Os autores agradecem a FAPESP (2023/12447-1), CNPq (405691/2021-1) e CAPES pelo apoio financeiro para o desenvolvimento desse trabalho. P.S., A.G.T. e J.H.G.L. agradecem ao CNPq pelas bolsas de produtividade em pesquisa.
REFERÊNCIAS 1. Carvalho-Silva, M.; Câmara, P. E. A. S.; Guimarães, E. F.; Acta Bot. Bras. 2022, 36, e20210360. [Crossref] 2. Jardim Botânico do Rio de Janeiro, Piper L., https://floradobrasil.jbrj.gov.br/FB12735, acessado em Maio 2025. 3. Salehi, B.; Zakaria, Z. A.; Gyawali, R.; Ibrahim, S. A.; Rajkovic, J.; Shinwari, Z. K.; Khan, T.; Sharifi-Rad, J.; Ozleyen, A.; Turkdonmez, E.; Valussi, M.; Tumer, T. B.; Fidalgo, L. M.; Martorell, M.; Setzer, W. N.; Molecules 2019, 24, 1364. [Crossref] 4. Woon, C. K.; Ahmad, F. B.; Zamakshshari, N. H.; Chem. Biodiversity 2023, 20, e202300166. [Crossref] 5. Parmar, V. S.; Jain, S. C.; Bisht, K. S.; Jain, R.; Taneja, P.; Jha, A.; Tyagi, O. D.; Prasad, A. K.; Wengel, J.; Olsen, C. E.; Boll, P. M.; Phytochemistry 1997, 46, 597. [Crossref] 6. Mgbeahuruike, E. E.; Yrjönen, T.; Holm, V. Y.; S. Afr. J. Bot. 2017, 112, 54. [Crossref] 7. Fan, D.; Zhou, C.; Chen, C.; Li, X.; Ma, J.; Hu, Y.; Li, G.; Ruan, J.; Wu, A.; Li, L.; Gong, X.; Fitoterapia 2023, 165, 105403. [Crossref] 8. Biswas, P.; Ghorai, M.; Mishra, T.; Gopalakrishnan, A. V.; Roy, D.; Mane, A. B.; Mundhra, A.; Das, N.; Mohture, V. M.; Patil, M. T.; Rahman, M. H.; Jha, N. K.; Batiha, G. E.; Saha, S. C.; Shekhawat, M. S.; Radha; Kumar, M.; Pandey, D. K.; Dey, A.; Phytother. Res. 2022, 36, 4425. [Crossref] 9. Durofil, A.; Radice, M.; Blanco-Salas, J.; Ruiz-Téllez, T.; Parasite 2021, 28, 42. [Crossref] 10. Valadeau, C.; Pabon, A.; Deharo, E.; Albán-Castillo, J.; Estevez, Y.; Lores, F. A.; Rojas, R.; Gamboa, D.; Sauvain, M.; Castillo, D.; Bourdy, G.; J. Ethnopharmacol. 2009, 123, 413. [Crossref] 11. Sun, X.; Chen, W.; Dai, W.; Xin, H.; Rahmand, K.; Wang, Y.; Zhang. J.; Zhang, S.; Xu, L.; Han, T.; J. Ethnopharmacol. 2020, 263, 112897. [Crossref] 12. Bosquiroli, L. S.; Demarque, D. P.; Rizk, Y. S.; Cunha, M. C.; Marques, M. C. S.; Matos, M. F. C.; Kadri, M. C.; Carollo, C. A.; Arruda, C. C.; Rev. Bras. Farmacogn. 2015, 25, 124. [Crossref] 13. Barh, D.; Barve, N.; Gupta, K.; Chandra, S.; Jain, N.; Tiwari, S.; Leon-Sicairos, N.; Canizalez-Roman, A.; dos Santos, A. R.; Hassan, S. S.; Almeida, S.; Ramos, R. T. J.; de Abreu, V. A. C.; Carneiro, A. R.; Soares, S. C.; Castro, T. L. P.; Miyoshi, A.; Silva, A.; Kumar, A.; Misra, A. N.; Blum, K.; Braverman, E. R.; Azevedo, V.; PLoS One 2013, 8, e52773. [Crossref] 14. Sarkar, A.; Sen, R.; Saha, P.; Ganguly, S.; Mandal, G.; Chatterjee, M.; Parasitol. Res. 2008, 102, 1249. [Crossref] 15. Vaghasiya, Y.; Nair, R.; Chanda, S.; Int. J. Pharmacol. 2007, 3, 400. [Crossref] 16. Danelutte, A. P.; Lago, J. H. G.; Young, M. C. M.; Kato, M. J.; Phytochemistry 2003, 64, 555. [Crossref] 17. Lago, J. H. G.; Ramos, C. S.; Casanova, D. C. C.; Morandim, A. A.; Bergamo, D. C. B.; Cavalheiro, A. J.; Bolzani, V. S.; Furlan, M.; Guimarães, E. F.; Young, M. C. M.; Kato, M. J.; J. Nat. Prod. 2004, 67, 1783. [Crossref] 18. Lago, J. H. G.; Kato, M. J.; Nat. Prod. Res. 2007, 21, 910. [Crossref] 19. Yamaguchi, L. F.; Lago, J. H. G.; Tanizaki, T. M.; Di Mascio, P.; Kato, M. J.; Phytochemistry 2006, 67, 1838. [Crossref] 20. Lopes, A. A.; López, S. N.; Regasini, L. O.; Batista Junior, J. M.; Ambrósio, D. L.; Kato, M. J.; Bolzani, V. S.; Cicarelli, R. M. B.; Furlan, M.; Nat. Prod. Res. 2008, 22, 1040. [Crossref] 21. Murta, S. M. F.; Santana, P. A. L.; Lapierre, T. J. W. J. D.; Penteado, A. B.; El Hajje, M.; Vinha, T. C. N.; Liarte, D. B.; de Souza, M. L.; Trossini, G. H. G.; Rezende Júnior, C. O.; de Oliveira, R. B.; Ferreira, R. S.; Expert Opin. Drug Discovery 2024, 19, 741. [Crossref] 22. Silva, M. L.; Baldim, J. L.; Costa-Silva, T. A.; Amaral, M.; Romanelli, M.; Levatti, E. V. C.; Tempone, A. G.; Lago, J. H. G.; J. Braz. Chem. Soc. 2025, 36, e-20240203. [Crossref] 23. Brito, I. A.; Levatti, E. V. C.; Regasini, L. O.; Ferreira, E. A.; Lopes, F. B.; Fernandes, J. P. S.; Batista Jr., J. M.; Tempone, A. G.; Lago, J. H. G.; Phytochemistry 2025, 231, 114360. [Crossref] 24. Kesper Jr., N.; de Almeida, K. A.; Stolf, A. M. S.; Umezawa, E. S.; J. Parasitol. 2000, 86, 862. [Crossref] 25. Martins, L. F.; Mesquita, J. T.; Pinto, E. G.; Costa-Silva, T. A.; Borborema, S. E.; Galisteo Junior, A. J.; Neves, B. J.; Andrade, C. H.; Al Shuhaib, Z.; Bennett, E. L.; Black, G. P.; Harper, P. M.; Evans, D. M.; Fituri, H. S.; Leyland, J. P.; Martin, C.; Roberts, T. D.; Thornhill, A. J.; Vale, S. A.; Howard-Jones, A.; Thomas, D. A.; Williams, H. L.; Overman, L. E.; Berlinck, R. G.; Murphy, P. J.; Tempone, A. G.; J. Nat. Prod. 2016, 79, 2202. [Crossref] 26. Tada, H.; Shiho, O.; Kuroshima, K.; Koyama, M.; Tsukamoto, K.; J. Immunol. Methods 1986, 93, 157. [Crossref] 27. Kumar, V.; Sharma, A.; Sinha, A. K.; Helv. Chim. Acta 2006, 89, 483. [Crossref] 28. Judd, K. E.; Caggiano, L.; Org. Biomol. Chem. 2011, 9, 5201. [Crossref] 29. Seeram, N. P.; Lewis, P. A.; Jacobs, H.; McLean, S.; Reynolds, W. F.; Tay, L.-L.; Yu, M.; J. Nat. Prod. 1996, 59, 436. [Crossref] 30. Capron, M. A.; Wiemer, D. F.; J. Nat. Prod. 1996, 59, 794. [Crossref]
Editor Convidado responsável pelo artigo: Lucas S. Abreu |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






