Assuntos Gerais
|
|
| 30 Anos das tabelas periódicas da SBQ: cursos passados e estado atual 30 Years of the SBQ periodic tables: past courses and current state |
|
Ana Paula de Lima BatistaI,#,* I. Departamento de Química, Universidade Federal de São Carlos, 13565-905 São Carlos - SP, Brasil Recebido: 09/04/2025 *e-mail: aplbatista@ufscar.br; antoniogsof@iqsc.usp.br; romeu@ufscar.br; yuri.aoto@ufabc.edu.br In 2025, the Brazilian Chemical Society (SBQ) celebrates the 30th anniversary of its periodic table of the elements, first launched in 1995 in two printed formats: an A4-sized version with detailed chemical information and a poster version with a simplified content. Over the years, these periodic tables have undergone continuous updates, reflecting changes in atomic weights, syntheses of new elements, and recommendations from the International Union of Pure and Applied Chemistry (IUPAC). This paper traces the historical development of the SBQ periodic tables, highlighting key modifications. Additionally, the paper presents in detail the latest updates introduced in the 2025 versions of SBQ periodic tables, now under the responsibility of the SBQ Periodic Table Curation Commission (CCTP/SBQ). These efforts aim to provide the most up-to-date and scientifically accurate periodic tables possible, supporting chemistry education and research in Brazil. Within this context, a table of the IUPAC standard atomic weights 2024 is also included in the paper. INTRODUÇÃO Este ano de 2025, em que a Sociedade Brasileira de Química (SBQ) celebra o seu 48º aniversário, é o do 30o aniversário da "Classificação Periódica da SBQ", lançada no 1° semestre de 1995 em dois formatos impressos: um pequeno (tamanho A4, a seguir referido como tabela periódica A4), com dois lados e rico em informações, e um grande - tipo poster (70 cm × 100 cm, a seguir referido como tabela periódica de parede), com um único lado e menos informações.1 A organização destas tabelas periódicas foi liderada por Aécio Pereira Chagas, docente do Instituto de Química da Unicamp, na época coordenador das Edições SBQ, que continuou participando ativamente das decisões sobre as suas atualizações até o final da década de 2000, com eventuais ajudas de um dos autores (RCRF) deste artigo. Do início da década de 2010 até maio de 2024, quando foi criada a Comissão de Curadoria das Tabelas Periódicas da SBQ (CCTP/SBQ), a responsabilidade por essas atualizações ficou a cargo de RCRF. A criação da CCTP/SBQ foi aprovada pela diretoria e pelo conselho consultivo da SBQ (mandatos 2022-2024), tendo sido formalizada aos membros da comissão por meio de um ofício da então presidente da SBQ, Shirley Nakagaki Bastos. Em novembro de 2019, como parte das comemorações do Ano Internacional da Tabela Periódica dos Elementos Químicos (IYPT2019), celebrado sob os auspícios da UNESCO (Organização das Nações Unidas para a Educação, a Ciência e a Cultura) e com apoio da IUPAC (União Internacional de Química Pura e Aplicada),2 uma terceira tabela periódica, mais simples e digital (arquivo em formato PDF de alta resolução - vetorial, a seguir referida como tabela periódica digital), foi lançada pela SBQ,3 sendo disponibilizada em seu site para ser baixada por quem se interessar (desde que se comprometa a não modificar a tabela e nem a usar para fins comerciais). A concepção desta tabela digital foi liderada por RCRF, que também se responsabilizou por sua atualização até a criação da CCTP/SBQ. A disponibilização pela SBQ de tabelas periódicas em diferentes formatos, sempre o mais atualizadas possível, atende principalmente aos anseios de professores, professoras, alunos e alunas, ao mesmo tempo que estimula (e apoia) o ensino da Química no País, caracterizando-se como uma atividade que contribui para a consecução dos objetivos da Sociedade, conforme estabelecido em seu estatuto. Tendo em conta as três décadas de existência dessas tabelas periódicas, este artigo visa registrar os diferentes cursos que elas trilharam desde os seus lançamentos e relatar, em detalhes, as atualizações implementadas em suas versões 2025, já sob a responsabilidade da CCTP/SBQ. Também se aproveita a ocasião para divulgar os valores atualizados (2024) dos pesos atômicos padrão publicados pela Comissão sobre Abundâncias Isotópicas e Pesos Atômicos (CIAAW - acrônimo do seu nome em inglês) da IUPAC.
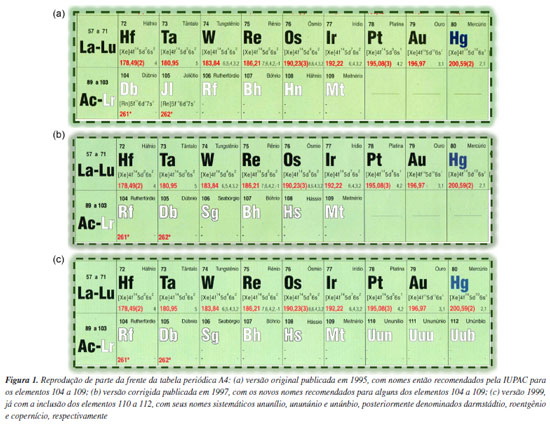
CURSOS PASSADOS Lançamento em época de polêmica As tabelas periódicas da SBQ foram lançadas em uma época em que o número de elementos nelas listados ainda era 109 e havia uma polêmica internacional sobre os nomes dos elementos 104 a 109 e a prioridade de descoberta de alguns deles (na literatura, às vezes, esta polêmica tem sido referida como "Guerras dos Transférmios").4,5 Em um dos lados desta polêmica, estava a ACS (Sociedade Americana de Química), e no outro, a IUPAC. Neste contexto, no início de 1994, para uso nos Estados Unidos, a ACS adotou oficialmente os seguintes nomes para os elementos 104 a 109, previamente aprovados por seu Comitê sobre Nomenclatura: 104 - rutherfórdio; 105 - hâhnio; 106 - seabórgio; 107 - nielsbóhrio; 108 - hássio; 109 - meitnério. Entretanto, no segundo semestre de 1994, o Bureau da IUPAC, de modo expedito, contrariando alguns procedimentos usuais para a aprovação oficial de nomes de novos elementos,6 adotou nomes discordantes e definitivos para eles, exceto o do elemento 109, como sugerido pela Comissão sobre Nomenclatura de Química Inorgânica (CNQI) da sua Divisão de Química Inorgânica:7,8 101 - mendelévio (Md); 102 - nobélio (No); 103 - laurêncio (Lr); 104 - dúbnio (Db); 105 - joliôtio (Jl); 106 - rutherfórdio (Rf); 107 - bóhrio (Bh); 108 - hâhnio (Hn); 109 - meitnério (Mt). Cabe notar que, até então, nenhum elemento tinha sido nomeado homenageando um cientista vivo, como decidira a ACS para o caso do elemento 106, ao homenagear o químico americano Glenn Theodore Seaborg (1912-1999), envolvido na descoberta de diversos elementos transurânicos, inclusive a do próprio elemento 106 (já em 1951, ele fora laureado com o Prêmio Nobel de Química, juntamente com Edwin Mattison McMillan, por "suas descobertas na química dos elementos transurânicos"). A bem da verdade, não havia uma regra oficial sobre isso, mas essa era a tradição. Com o intuito de referendá-la, durante o processo de aprovação dos nomes dos elementos 101 a 109, a CNQI decidiu, por 16 votos a 4, que um elemento não deveria ser nomeado em homenagem a uma pessoa viva, justificando que "era necessário ter uma perspectiva da história em relação a essas descobertas antes que uma decisão fosse tomada".7 Tão logo a IUPAC divulgou os nomes e símbolos definitivos para os elementos transférmios, uma forte contrariedade da ACS foi imediatamente manifestada, tendo o seu Comitê sobre Nomenclatura decidido continuar lutando pelo nome seabórgio para o elemento 106 e reafirmar o seu apoio aos nomes anteriormente propostos.9 O posicionamento da ACS tinha o apoio da comunidade química alemã, a qual contava com descobridores dos elementos 107 a 109. Essa era a situação quando as tabelas periódicas impressas da SBQ foram lançadas e, portanto, nelas foram incorporados os nomes e símbolos definitivos então recomendados pela IUPAC (vide Figura 1a).
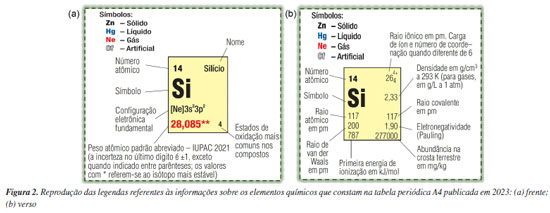
Dado o firme posicionamento contrário de parte da comunidade química internacional aos nomes oficializados no final de 1994 e o modo como a questão havia sido tratada, ainda em setembro de 1995 o Bureau da IUPAC decidiu reverter para provisório o caráter definitivo dos nomes recomendados para os elementos transférmios, algo inédito e que foi acatado pelo Conselho da IUPAC.6,10,11 Por conseguinte, durante o 1º semestre de 1996, a IUPAC recebeu comentários da comunidade química internacional sobre esses nomes provisórios, que foram levados em conta pela CNQI/IUPAC em uma reunião realizada em agosto de 1996, quando os nomes de quatro elementos (104, 105, 106 e 108) foram revisados, ficando assim a nova lista de nomes definitivos:10,11 101 - mendelévio (Md); 102 - nobélio (No); 103 - laurêncio (Lr); 104 - rutherfórdio (Rf); 105 - dúbnio (Db); 106 - seabórgio (Sg); 107 - bóhrio (Bh); 108 - hássio (Hs); 109 - meitnério (Mt). Comparando-se estes nomes definitivos com os anteriormente aprovados pela ACS e pela CNQI/IUPAC, vê-se que dois nomes (hâhnio e joliôtio) foram deixados de lado para acomodar nomes sugeridos pela ACS (seabórgio e hássio, respectivamente). Essa nova lista de nomes definitivos foi divulgada pela IUPAC em fevereiro de 1997,10 aprovada pelo seu Conselho em agosto de 1997,12 e finalmente publicada em dezembro de 1997.11 Em consequência disso, ainda em 1997, as tabelas periódicas da SBQ foram reimpressas com os novos nomes definitivos (vide Figura 1b). Cabe aqui notar que, neste mesmo ano, foram anunciadas as sínteses de nuclídeos dos elementos 110 (nome sistemático: ununílio), 111 (ununúnio) e 112 (unúnbio), realizadas no Gesellschaft für Schwerionenforschung (GSI — Centro de Pesquisas sobre Íons Pesados), em Darmstadt, Alemanha.10 Estes novos elementos (então sem nomes definitivos) foram incorporados à versão 1999 da tabela periódica A4 (vide Figura 1c). Adoção da expressão "peso atômico" Aqui cabe destacar que até recentemente, nas tabelas periódicas impressas (formato A4 e poster), os pesos atômicos foram referidos como "massas atômicas relativas", uma opção de nomenclatura feita quando do lançamento das tabelas em 1995 (vide Chagas),1 dado que rigorosamente o uso do termo peso é incorreto, pois, na realidade, se trata de massa. Em 2019, quando do lançamento da tabela periódica digital, nela se adotou diretamente a expressão "peso atômico padrão", em concordância com a prática da CIAAW e com o entendimento de que esta expressão histórica equivale a um valor recomendado para a "massa atômica relativa" (ou para a "massa atômica relativa média", para elementos que têm dois ou mais isótopos com uma abundância isotópica característica em amostras terrestres).13 Para as tabelas periódicas da SBQ, existe a expectativa de que os valores dos pesos atômicos que nelas constam sejam o mais atualizados possível. Assim, toda vez que valores de pesos atômicos revisados são divulgados pela CIAAW, sempre se buscou fazer sua atualização nas tabelas periódicas da SBQ, se pertinente (para valores com no máximo cinco algarismos significativos)1 e tão logo possível. Neste sentido, uma decisão marcante da CIAAW, tomada em 2009, foi a de expressar os pesos atômicos padrão de 10 elementos (H, Li, B, C, N, O, Si, S, Cl e Tl) como um intervalo de valores.14-16 Esta decisão decorreu da constatação de variabilidade nos pesos atômicos desses elementos em materiais terrestres naturais, em outras palavras, do fato de a abundância isotópica de seus dois ou mais isótopos variar em materiais normais. Assim, por exemplo, naquela ocasião os pesos atômicos padrão do silício e do cloro passaram a ser expressos como [28,084; 28,086] e [35,446; 35,457].14 Para sanar a necessidade de valores representativos para esses elementos, por exemplo na indústria e no comércio (e mesmo no ensino), a CIAAW forneceu um respectivo valor único, referido como peso atômico convencional; nos casos do silício e do cloro, 28,085 e 35,45, respectivamente.14 Nas tabelas periódicas da SBQ, então passaram a constar os valores convencionais dos pesos atômicos desses 10 elementos, indicando-se que, a partir de 2010, a IUPAC passara a recomendar faixas de valores para expressar os seus pesos atômicos padrão. Cabe notar que, no momento, são 14 os elementos cujos pesos atômicos padrão são expressos como uma faixa de valores (H, Li, B, C, N, O, Mg, Si, S, Cl, Ar, Br, Tl e Pb), em decorrência das inclusões do bromo e magnésio, a partir dos pesos atômicos 2011,17 e do argônio e chumbo, a partir dos pesos atômicos 2021,18 quando deixou-se de usar a expressão peso atômico convencional - vide abaixo a seção "ESTADO ATUAL: Padronização de informações comuns a todas as tabelas". Tabelas periódicas impressas Nas tabelas periódicas impressas, as designações numéricas para os grupos (1 a 18) e os períodos (1 a 7) recomendadas pela IUPAC são apresentadas de forma destacada, sendo que, para os grupos, originalmente também foram incluídas as designações antigas (com menos destaque, em vermelho). Aqui cabe notar que, na versão 2024 da tabela periódica de parede (formato poster), essas designações antigas (obsoletas) dos grupos foram deixadas de fora, como já fora feito, em 2019, ao se conceber a tabela periódica digital. As tabelas periódicas impressas contêm informações referentes aos elementos químicos e a grandezas e unidades de medida, bem como a valores de constantes físicas. Portanto, no curso de existência dessas tabelas, essas informações foram sendo atualizadas, sempre que necessário ou oportuno. Tabela A4 Na Figura 2 são reproduzidas as legendas referentes às informações sobre os elementos químicos que constam na frente e no verso da versão 2023 da tabela periódica A4. Casualmente, ao conceber as tabelas periódicas optou-se por usar o silício nestas legendas, um dos elementos cujo peso atômico padrão passou a ser expresso como um intervalo de valores, a partir de 2009, ao qual é atribuído um valor único para, por exemplo, uso educacional (essa informação, associada ao asterisco duplo na legenda, consta em outro ponto da frente da tabela: "Valor único, adotado para fins educacionais e comerciais. Atualmente, a IUPAC recomenda faixas de valores para expressar os pesos atômicos padrão desses elementos. Para conhecer estas faixas de valores e mais detalhes sobre elas, consulte a página da Comissão sobre Abundâncias Isotópicas e Pesos Atômicos da IUPAC: https://ciaaw.org/atomic-weights.htm"). Nota-se ainda que, para diversos elementos radioativos que carecem de isótopos com uma distribuição isotópica característica em amostras terrestres (portanto, carecem de peso atômico padrão), simplesmente consta a massa atômica relativa do respectivo isótopo mais estável. Aqui cabe esclarecer que, nesses anos todos de existência da tabela periódica A4, dentre todas essas informações, somente os valores dos pesos atômicos foram sendo atualizados, sempre que necessário e tão logo possível.
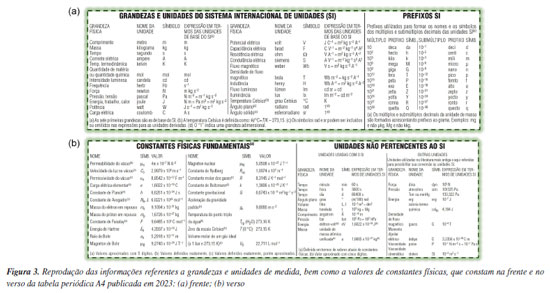
Na Figura 3, são reproduzidas as informações referentes a grandezas e unidades de medida, bem como a valores de constantes físicas que constam na frente e no verso da versão 2023 da tabela periódica A4. Aqui, analogamente ao caso dos pesos atômicos padrão, à medida que surgiram novidades, essas informações foram atualizadas. Por exemplo, quando a tabela periódica A4 foi lançada, os prefixos SI nela incluídos compreendiam ordens de grandeza na faixa de 10–18 (prefixo atto, símbolo a) a 1018 (prefixo exa, símbolo E), posteriormente passando para 10–24 (prefixo yocto, símbolo y) a 1024 (prefixo yotta, símbolo Y), com a incorporação de quatro outros prefixos SI aprovados desde a 19ª Conferência Geral de Pesos e Medidas (CGPM) em 1991,19 e hoje ela vai de 10–30 (prefixo quecto, q) a 1030 (prefixo quetta, Q), pois em novembro de 2022, a 27ª CGPM aprovou quatro novos prefixos SI,19 logo depois incorporados na versão 2023 da tabela periódica A4 (bem como na versão 2024 da tabela periódica de parede).
Tabela de parede A legenda referente às informações sobre os elementos químicos que consta na versão 2024 da tabela periódica de parede é reproduzida na Figura 4. Comparando-se esta figura com a Figura 2a, referente a informações similares que constam na versão 2023 da tabela periódica A4, vê-se que a única diferença é a inexistência, na tabela periódica de parede, de valores dos estados de oxidação mais comuns nos compostos. Além disso, na versão 2024 da tabela periódica de parede, para aqueles elementos radioativos que carecem de isótopos com uma distribuição isotópica característica em amostras terrestres, optou-se por não listar nenhuma informação (na versão 2023 da tabela periódica A4, consta a massa atômica relativa do isótopo mais estável). Essa é uma questão que necessitava de padronização, sendo que isso foi feito nas versões 2025 das tabelas, como será descrito mais adiante.

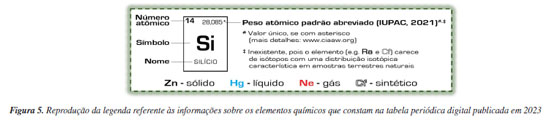
Quanto às informações referentes a grandezas e unidades de medida e aos valores de constantes físicas que constam na tabela periódica de parede, são as mesmas que constam na tabela periódica A4, frente e verso. Comparando-se essas informações nas duas tabelas, percebe-se algumas poucas pequenas diferenças. Por exemplo, na versão 2023 da tabela periódica A4, na parte referente a constantes físicas fundamentais, consta "carga elétrica elementar", enquanto na versão 2024 da tabela periódica de parede consta simplesmente "carga elementar", ou, ainda, constam esferorradiano e esterradiano, respectivamente, para a unidade de ângulo sólido (atualmente, no Brasil, esferorradiano é o nome oficial desta unidade, e esterradiano, em Portugal).20 Esses detalhes também necessitavam de padronização, sendo que isso foi feito nas versões 2025 das tabelas, como será descrito mais adiante. Tabela periódica digital Como já mencionado, a tabela periódica digital é uma versão simplificada e, portanto, contém um número reduzido de informações. A legenda referente às informações que constam na sua versão 2023 é reproduzida na Figura 5. Comparando-se esta legenda com as análogas que constam na tabela periódica A4 (versão 2023) - Figura 2a - e na de parede (versão 2024) - Figura 4, vê-se que ela efetivamente contém menos informações, pois nela não constam a configuração eletrônica do estado fundamental (presente nas duas outras tabelas) e os estados de oxidação mais comuns nos compostos (presentes somente na tabela periódica A4). Além disso, para aqueles elementos radioativos que carecem de isótopos com uma distribuição isotópica característica em amostras terrestres, optou-se por informar que inexiste um valor de peso atômico padrão abreviado (mesma opção depois feita para a versão 2024 da tabela periódica de parede).
ESTADO ATUAL Padronização de informações comuns a todas as tabelas Nas versões 2025 de todas as tabelas periódicas da SBQ (impressas e digital), as seguintes informações comuns foram padronizadas (e atualizadas, se o caso): (i) numeração dos grupos só segundo recomendado pela IUPAC, isto é, de 1 a 18; (ii) nomes dos elementos grafados em caixa-baixa e com mesma grafia; (iii) valor do seu peso atômico padrão abreviado recomendado pela IUPAC em 2024 (com até cinco algarismos significativos)18,21,22 ou do número de massa (entre colchetes) do seu nuclídeo mais estável se o elemento não tem isótopos com uma abundância isotópica característica em amostras terrestres naturais. Além disso, todas as tabelas passaram a ter o título mais usual: "Tabela Periódica dos Elementos". Portanto, deixou-se de lado o título presente nas tabelas impressas desde suas concepções em 1995: "Classificação Periódica dos Elementos". Grande parte dessa padronização pode ser depreendida, por exemplo, da nova legenda da tabela digital - vide Figura 6. Cabe destacar que as grafias adotadas para os nomes dos elementos de número atômico 36, 93, e 97, respectivamente kriptônio (Kr), neptúnio (Np) e berkélio (Bk), discordam das propostas anteriormente,24 mas são concordantes com os respectivos símbolos e, ademais, não afrontam as normas ortográficas atuais, sendo que as grafias berkélio e neptúnio já estão listadas no Dicionário da Língua Portuguesa online da Academia Brasileira de Letras.25
Em relação a tabelas de pesos atômicos padrão com até cinco algarismos significativos, cabe aqui relembrar como surgiram e evoluíram no âmbito da CIAAW. A partir da divulgação dos pesos atômicos padrão 1981, com o entendimento de que valores de pesos atômicos padrão com elevado número de algarismos significativos, além de serem sujeitos a mudanças mais frequentes, excedem as necessidades de muitos usuários (e.g. tabelas em livros-textos ou tabelas periódicas como as da SBQ), a CIAAW passou a publicar tabelas de pesos atômicos com cinco algarismos significativos (ou menos, se incertezas não permitem nem mesmo uma precisão de cinco algarismos significativos)26 - tabelas similares com quatro algarismos significativos também foram publicadas pela CIAAW (inicialmente para o Comitê sobre Ensino de Química da IUPAC),27,28 mas posteriormente abandonadas ao divulgar os pesos atômicos padrão 2013,29 com a justificativa de que os erros de arredondamento introduzidos nessas tabelas são inaceitáveis. Em 2009, passado mais de um quarto de século da primeira publicação de uma tabela de pesos atômicos padrão com até cinco algarismos significativos, a partir da divulgação dos pesos atômicos padrão 2007, a CIAAW passou a denominar tais valores de "pesos atômicos padrão abreviados".28 Com a decisão da CIAAW, em 2009, de expressar os pesos atômicos padrão de alguns elementos como uma faixa de valores (vide acima), na tabela de pesos atômicos padrão abreviados passaram a constar essas faixas de valores para esses elementos, abreviados sempre que pertinente. Isto fez que a CIAAW também tivesse que publicar uma tabela de valores de "pesos atômicos convencionais", cada um deles com um respectivo valor representativo, sem incertezas; por exemplo, para o silício e o cloro, cujas faixas de peso atômico padrão abreviado 2009 eram [28,084; 28,086] e [35,446; 35,457], valores de 28,085 e 35,45, respectivamente.14 A partir de então, nas tabelas periódicas impressas da SBQ, para esses elementos cujos pesos atômicos padrão passaram a ser expressos como faixas de valores, os respectivos valores dos seus pesos atômicos convencionais foram incluídos, com a adição de uma breve nota explicativa. Mais recentemente, a CIAAW, ao divulgar os valores dos pesos atômicos padrão 2021,18 passou a incorporar os pesos atômicos convencionais diretamente na tabela de pesos atômicos padrão abreviados, manifestando que esses valores únicos de pesos atômicos podem ser usados sempre que necessário e se o número de algarismos significativos for suficiente para uso adicional. Com isso, deixaram de existir os tais pesos atômicos convencionais e, portanto, nas versões 2025 das tabelas periódicas da SBQ qualquer nota explicativa se tornou desnecessária, constando apenas os valores recomendados dos pesos atômicos padrão abreviados e indicando-se o site da CIAAW para mais informações, se necessário (vide Figura 6). Em relação às incertezas associadas a estes valores, esclarecimentos são dados abaixo, ao se divulgar os valores dos pesos atômicos padrão 2024 recomendados pela CIAAW. Para os elementos radioativos que não possuem peso atômico padrão por carecerem de isótopos com uma distribuição isotópica característica em amostras terrestres (e.g. Ra e Cf), em vez da massa atômica do seu nuclídeo mais estável, decidiu-se simplesmente indicar o número de massa deste nuclídeo, entre colchetes. Assim, deixou-se de misturar, nas tabelas, valores de pesos atômicos padrão e de massas nuclídicas, grandezas conceitualmente diferentes (apesar de coincidentes nos casos em que o elemento é monoisotópico, como ocorre para 19 elementos).30 Aqui cabe comentar que, para alguns elementos, devido às incertezas nas determinações experimentais das meias-vidas, não há um único isótopo que possa ser considerado mais estável. Nestes casos, assim como a IUPAC fez em sua tabela periódica mais recente,31 considerou-se simplesmente os valores numéricos das meias-vidas recomendados pela CIAAW.32 Por exemplo, para o elemento tecnécio indica-se o nuclídeo com número de massa 97 como o mais estável, com meia-vida t1/2 = 4,21 ± 0,16 Ma, embora o tecnécio-98, com t1/2 = 4,2 ± 0,3 Ma, possa ser considerado igualmente estável. Padronização de informações comuns às tabelas impressas Visando uma padronização visual destas tabelas, adotou-se a fonte Helvetica Neue LT Std (e suas variações). Além disso, como mencionado anteriormente, foram padronizadas as informações referentes a grandezas e unidades de medida, bem como a valores de constantes físicas. Para esta padronização, foram utilizadas versões em português e inglês da brochura do SI19,20 e do Livro Verde da IUPAC,33,34 dando-se prioridade (se necessário), para nomenclatura, ao estabelecido no Livro Verde. No caso das constantes físicas, foi utilizado o relatório mais recente de valores recomendados pelo CODATA - Committee on Data of the International Science Council.35 Para a atualização dos valores de diferentes grandezas referentes aos elementos, como premissa geral optou-se por adotar como fonte primária o CRCHandbook of Chemistry and Physics (CRC-HCP),36 sempre indicando se outra fonte foi usada. Aqui cabe destacar: (i) como já feito para os nomes dos elementos químicos, adoção de grafia em caixa-baixa para os nomes de grandezas e constantes físicas (exceto eponimias); (ii) o nome da grandeza "permeabilidade do vácuo" foi atualizado para "constante magnética" (além disso, o seu valor deixou de ser exato); (iii) o nome da grandeza "permissividade do vácuo" foi atualizado para "constante elétrica"; (iv) o nome da "constante dos gases" foi atualizado para "constante molar dos gases"; (v) o nome da "constante gravitacional" foi atualizado para "constante newtoniana da gravitação" (suas unidades passaram a ser expressas só como unidades de base do SI); (vi) o nome da "temperatura do ‘ponto zero' da escala Celsius" foi atualizado para "zero da escala Celsius" (sem símbolo); (vii) as expressões de unidades derivadas em termos de unidades SI de base foram revisadas para se ater ao recomendado pelo SI;19,20 (viii) o nome da unidade "atmosfera" foi atualizado para "atmosfera padrão"; (ix) a unidade Dalton, equivalente à unidade de massa atômica unificada, foi incluída entre as unidades usadas com o SI. Finalmente, as configurações eletrônicas do estado fundamental, agora presentes até o elemento de número atômico 108 (hássio), foram revisadas e atualizadas seguindo as informações disponíveis na Base de Dados de Espectros Atômicos do NIST.37 Para este fim específico, considerou-se que a base de dados do NIST é mais completa e atualizada que o CRC-HCP. Este, por exemplo, lista configurações eletrônicas até o elemento de número atômico 104 (rutherfórdio) e cita a Base de Dados de Espectros Atômicos do NIST de 2013 como referência. Tabela periódica A4 Na tabela periódica A4, além das já descritas modificações comuns às outras tabelas periódicas, foram realizadas a verificação e conferência de todas as outras informações referentes aos elementos, como descrito a seguir. Na parte da frente da tabela, os valores dos estados de oxidação mais comuns nos compostos (com os principais indicados em negrito) foram revisados segundo constam no livro de referência The Elements.38 Vale a pena chamar atenção para o fato de que implicitamente, nesta listagem, há a subjetividade de se definir o que é mais comum e o que é principal, questões cuja resolução está completamente fora do escopo da produção das tabelas periódicas da SBQ. Por isso, seguiu-se diretamente as informações publicadas por Emsley,38 mas desconsiderando valores indicados como raros, suspeitos, duvidosos ou transientes (note-se que a IUPAC recomenda que valores de estados de oxidação sejam grafados em algarismos romanos, mas aqui esses são indicados em algarismos arábicos, pois assim estão na tabela periódica A4, por questão de espaço). Especificamente, desconsiderou-se: o estado de oxidação –1 para Li, Na, K e Rb, quando dissolvidos em amônia líquida; o estado de oxidação zero para o Kr, que ocorre para clatratos e não compostos verdadeiros; o estado de oxidação 8 para o Au, cuja existência não foi verificada ou reproduzida.39 Além disso, a posição dos estados de oxidação na tabela foi alterada para acomodar as informações para elementos com grande variedade de estados de oxidação observados, por exemplo, o ósmio com estados de oxidação 8, 6, 5, 4, 3, ±2, 1, 0. No verso da tabela, além do número atômico e símbolo de cada elemento, constam, sempre que possível, os valores de seus raio atômico, raio de van der Waals, raio iônico, raio covalente, primeira energia de ionização, densidade, eletronegatividade e abundância na crosta terrestre. Para os raios de átomos não se tem uma definição precisa, mas são úteis para se entender estruturas e interações moleculares e os fatores que as afetam. Considerando os objetivos da tabela periódica A4 da SBQ, resolveu-se manter as quatro classes de raios presentes nas suas versões anteriores, revisando e atualizando seus valores quando necessário. O raio covalente de um elemento corresponde ao valor médio da contribuição daquele elemento para a distância de equilíbrio de uma ligação covalente simples, tendo sido obtido a partir de dados experimentais e computacionais para todos os 118 elementos, conforme disponível no CRC-HCP.36 Para o raio de van der Waals, existem múltiplas definições e eles podem ser obtidos a partir de uma grande variedade de abordagens baseadas em informações experimentais e/ou computacionais. De maneira geral, o raio de van der Waals deve representar a distância de contato (início da parte repulsiva da curva de energia potencial) em interações não ligadas, sendo maior que o raio covalente. Os valores de raios de van der Waals na versão atual da tabela são os do CRC-HCP,36 disponíveis para quase todos os elementos, incluindo até o elemento de número atômico 103 (laurêncio). Os valores de raios iônicos também foram transcritos do CRC-HCP.36 Contudo, escolheu-se incluir na tabela periódica A4 só um subconjunto dos dados disponíveis, que se acredita ser representativo e útil para avaliar a estrutura de cristais. Considerando a limitação de espaço na tabela, foram incluídos apenas os raios iônicos para os íons com número de coordenação igual a seis, cujas cargas correspondem aos estados de oxidação principais daquele elemento. Por exemplo, para o irídio, constam os valores 63 pm e 68 pm para os raios dos íons Ir4+ e Ir3+, respectivamente, já que os principais estados de oxidação para este elemento são o IV e o III. A única exceção para o número de coordenação seis é para o elemento rádio, para o qual consta o valor 148 pm para o raio do íon Ra2+ com número de coordenação igual a oito, por não haver valor disponível para número de coordenação seis. Por fim, para raios atômicos, optou-se pelos valores que constam no livro de referência The Elements,38 que estão, tipicamente, entre os valores dos raios covalente e de van der Waals. Para a densidade dos diferentes elementos, optou-se pelos seus valores na temperatura de 25 °C e na pressão padrão de 1 bar, com até três algarismos significativos. A fonte dos dados é também o CRC-HCP,36 que disponibiliza valores para quase todos os elementos até o elemento de número atômico 98 (califórnio), exceto para astato e frâncio. Para os elementos gasosos, a densidade foi calculada usando a lei dos gases ideais nas condições especificadas acima. No caso da primeira energia de ionização, seu valor foi revisado e atualizado para os elementos até o número atômico 104, exceto para o astato. Mais uma vez, foram usadas informações do CRC-HCP,36 convertendo os respectivos valores originalmente expressos em elétrons-volt para a unidade SI kilojoules por mol, assim garantindo maior uniformidade e compatibilidade com os valores de outras grandezas termodinâmicas. Por fim, os valores de eletronegatividade (escala de Pauling) e de abundância na crosta terrestre foram revisados e atualizados, também de acordo com os valores que constam no CRC-HCP.36
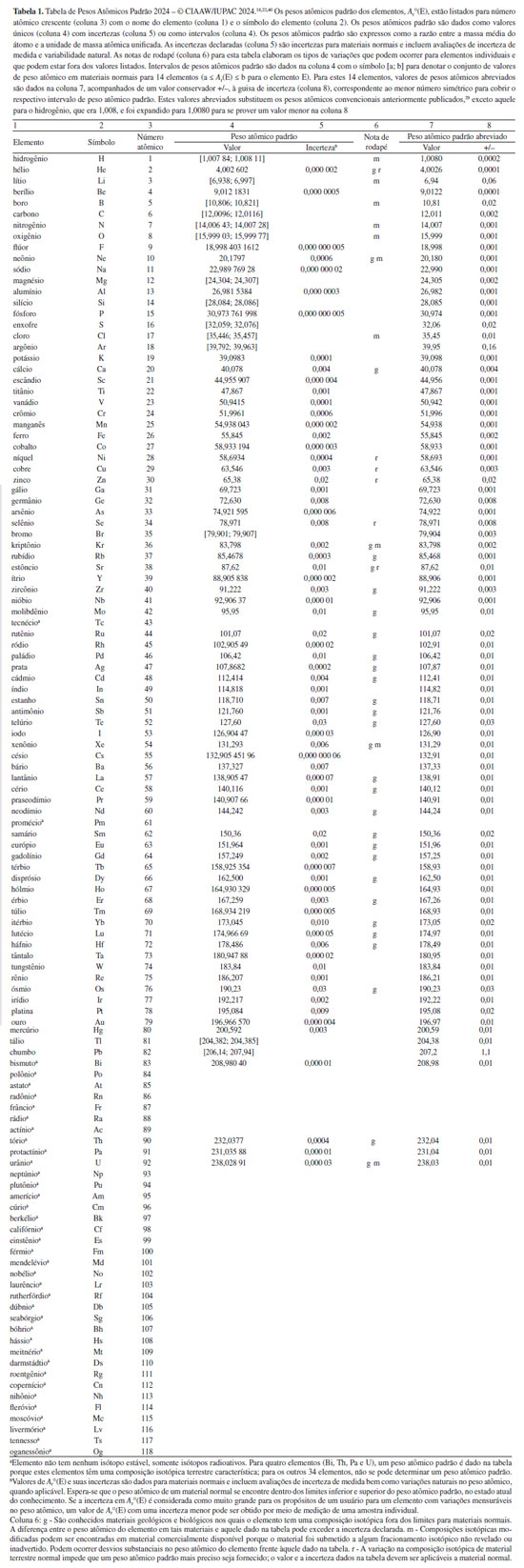
PESOS ATÔMICOS PADRÃO 2024 No final de outubro de 2024, a IUPAC postou em seu site um comunicado de imprensa sobre a aprovação pela CIAAW de novos pesos atômicos padrão recomendados para três elementos: gadolínio, lutécio e zircônio.40 Estes novos valores junto com os valores de 2021 para os outros elementos18 constituem o que a CIAAW passou a denominar como pesos atômicos padrão 2024.22 A seguir, se faz uma divulgação detalhada e fiel dos valores destes pesos atômicos padrão 2024 (e dos respectivos pesos atômicos padrão abreviados), aqui publicando os valores da tabela de pesos atômicos padrão 202118 modificados com os novos valores recomendados para Gd, Lu e Zr, juntamente com algumas informações que permitem uma melhor compreensão dos dados contidos na tabela (em especial, as incertezas associadas aos valores dos pesos atômicos padrão) - vide Tabela 1. Note-se que, dada a natureza dessas informações, tanto a tabela como parte do texto abaixo envolvem trechos traduzidos com implícito consentimento da IUPAC.
Como nas tabelas periódicas da SBQ constam os valores dos pesos atômicos padrão abreviados e suas incertezas, cabe destacar as regras que pautaram a definição desses valores pela CIAAW, conforme relatadas no artigo de Prohaska et al.:18 (i) Para elementos que não têm um peso atômico padrão expresso como um intervalo e que têm um valor de peso atômico padrão, Ar°(E), expresso com cinco ou menos algarismos significativos, o valor do peso atômico padrão abreviado (coluna 7) corresponde diretamente ao valor na coluna 4. Portanto, a incerteza do peso atômico padrão abreviado (coluna 8) também corresponde diretamente ao valor na coluna 5 (Tabela 1). (ii) Para elementos que não têm seu peso atômico padrão expresso como um intervalo e que têm um peso atômico padrão com mais de 5 algarismos significativos, o valor de Ar°(E) é abreviado para 5 algarismos significativos na coluna 7. O valor de incerteza conservador dado na coluna 8 para esses elementos corresponde ao valor posicional do último algarismo arredondado e, portanto, o algarismo menos significativo do valor na coluna 8, fornecendo a confiabilidade do respectivo valor de peso atômico padrão abreviado. (iii) Para 14 elementos (Ar, B, Br, C, Cl, H, Li, Mg, N, O, Pb, S, Si e Tl), o valor de Ar°(E) é dado como um intervalo de peso atômico na coluna 4 (Tabela 1). Para esses elementos, um valor único é fornecido na coluna 7. Estes valores podem ser usados se um valor único de peso atômico for necessário e o número de algarismos significativos for suficiente para uso posterior. Cabe notar que o valor fornecido na coluna 7 para esses elementos não corresponde necessariamente aos pontos médios dos intervalos (no caso de Li, Mg, S, Ar e Pb), e muitos correspondem aos valores do peso atômico de materiais de referência usados com frequência (por exemplo, NIST SRM981, para Pb; argônio no ar troposférico, para Ar).18 À guisa de incerteza, um respectivo valor conservador +/− é fornecido na coluna 8, o qual corresponde ao menor número simétrico para cobrir o intervalo de peso atômico padrão. Portanto, são três os tipos de incerteza associada aos pesos atômicos padrão abreviados: a própria incerteza do valor do respectivo peso atômico padrão (elementos incluídos no item i acima), uma confiabilidade (elementos incluídos no item ii acima) e uma incerteza simplificada expressa como um valor conservador +/– (elementos incluídos no item iii acima).
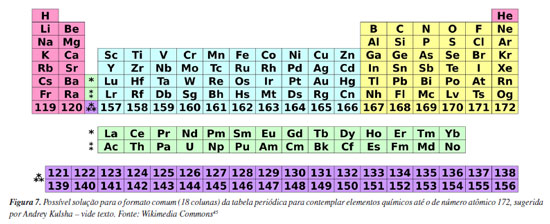
CONSIDERAÇÕES FINAIS Vive-se em uma época na qual a informação é tão abundante e de origens tão diversas que torna a escolha de fontes confiáveis muito difícil. Nesse contexto, a seleção cuidadosa dos dados inseridos nas versões revisadas 2025 das tabelas periódicas da SBQ, a partir de fontes claras e de reconhecimento internacional, resultou em um material importante para a comunidade química brasileira. Para os próximos anos, com certeza pode-se esperar novas atualizações de valores das grandezas que constam nas tabelas periódicas da SBQ, sendo que a CCTP/SBQ ficará atenta a isso, acompanhando eventuais novidades divulgadas por diferentes fontes, em especial pela CIAAW e por novas edições do CRC-HCP. Dado que o 7º período da tabela periódica passou a ser completo com a síntese do elemento 118 (oganessônio), a síntese de novos elementos químicos, para além deste elemento, poderá ser algo disruptivo, não só em termos do formato da tabela,41 mas também da própria periodicidade de propriedades químicas42,43 e da estabilidade dos nuclídeos que serão sintetizados (a prevista, e frequentemente mencionada, ilha de estabilidade será confirmada?).44 Seguramente, tais avanços na nucleossíntese de novos elementos superpesados farão com que a diagramação da tabela periódica, como um todo, seja afetada e a comissão acompanhará de perto o que será sugerido pela IUPAC. Note-se que possíveis soluções para o formato comum (18 colunas) ou o longo (50 colunas) da tabela periódica têm sido sugeridas, entre elas as do químico russo Andrey Kulsha.41 Sua sugestão de solução para o formato comum, contemplando elementos químicos até o de número atômico 172, pode ser vista na Figura 7. Nela se destacam duas linhas de elementos (números atômicos 121 a 138 e 139 a 156), análogas às dos lantanídios e actnídios, os quais ele denominou de "elementos de ultransição".41
Finalmente, cabe apontar, sem ser exaustivos, alguns artigos referentes à tabela periódica publicados neste periódico, abordando aspectos históricos dela46-48 e dos pesos atômicos,49 sua presença no ensino de Química,50,51 bem como aspectos modernos a ela relacionados.52 Neste último artigo, Toma52 se referiu à tabela periódica como "o verdadeiro Portal da Química", enquanto anteriormente Lima et al.48 a classificaram como "a mais concisa enciclopédia criada pelo ser humano". De fato!
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados estão disponíveis no texto.
AGRADECIMENTOS Os autores agradecem o apoio da diretoria da Sociedade Brasileira de Química para a realização das atividades de atualização das tabelas periódicas da SBQ, especialmente, as dos biênios 2022-2024 e 2024-2026. Também agradecem à CAPES - Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (código de financiamento 001), à FAPESP - Fundação de Amparo à Pesquisa do Estado de São Paulo (processos No. 2021/00675-4 e 2022/12043-5) e ao CNPq - Conselho Nacional de Desenvolvimento Científico e Tecnológico (processos No. 315175/2021-4 e 309572/2021-5) por bolsas e apoios financeiros concedidos. Finalmente, agradecem o esmerado apoio técnico para a adequada formatação das tabelas dado por Hermano Matos e Nerilso Guimarães Bocchi.
REFERÊNCIAS 1. Chagas, A. P.; Quim. Nova 1995, 18, 398. [Link] acessado em maio 2025 2. The International Year of the Periodic Table, https://iypt2019.org, acessado em maio 2025. 3. Viana, M. H., Iniciativas com a Tabela Periódica Ajudam no Ensino e na Divulgação Científica, 2019, https://boletim.sbq.org.br/noticias/2019/n3434.php, acessado em maio 2025. 4. Karol, P. J.; Chem. Eng. News 1994, 72, 2. [Crossref] 5. Rothstein, L.; Hibbs, M.; Bull. At. Sci. 1995, 51, 5. [Crossref] 6. Rocha-Filho, R. C.; Quim. Nova Esc. 1995, 2, 13. [Link] acessado em maio 2025 7. Inorganic Chemistry Division, Commission on Nomenclature of Inorganic Chemistry; Pure Appl. Chem. 1994, 66, 2419. [Crossref] 8. Freemantle, M.; Dagani, R.; Chem. Eng. News 1994, 72, 4. [Crossref] 9. Dagani, R.; Chem. Eng. News 1994, 72, 8. [Crossref] 10. Rocha-Filho, R. C.; Quim. Nova Esc. 1997, 5, 11. [Link] acessado em maio 2025 11. Inorganic Chemistry Division, Commission on Nomenclature of Inorganic Chemistry; Pure Appl. Chem. 1997, 69, 2471. [Crossref] 12. Rocha-Filho, R. C.; Quim. Nova Esc. 1997, 6, 13. [Link] acessado em maio 2025 13. de Laeter, J. R.; Böhlke, J. K.; De Bièvre, P.; Hidaka, H.; Peiser, H. S.; Rosman, K. J. R.; Taylor, P. D. P.; Pure Appl. Chem. 2003, 75, 683. [Crossref] 14. Wieser, M. E.; Coplen T. B.; Pure Appl. Chem. 2011, 83, 359. [Crossref] 15. Coplen T. B.; Holden, N. E.; Chem. Int. 2011, 33, 10. [Link] acessado em maio 2025 16. Rocha-Filho, R. C.; Chagas, A. P.; Quim. Nova Esc. 2011, 33, 211. [Link] acessado em maio 2025 17. Wieser, M. E.; Holden, N.; Coplen, T. B.; Böhlke, J. K.; Berglund, M.; Brand, W. A.; De Bièvre, P.; Gröning, M.; Loss, R. D.; Meija, J.; Hirata, T.; Prohaska, T.; Schoenberg, R.; O'Connor, G.; Walczyk, T.; Yoneda, S.; Zhu, X.-K.; Pure Appl. Chem. 2013, 85, 1047. [Crossref] 18. Prohaska, T.; Irrgeher, J.; Benefield, J.; Böhlke, J. K.; Chesson, L. A.; Coplen, T. B.; Ding, T.; Dunn, P. J. H.; Gröning, M.; Holden, N. E.; Meijer, H. A. J.; Moossen, H.; Possolo, A.; Takahashi, Y.; Vogl, J.; Walczyk, T.; Wang, J.; Wieser, M. E.; Yoneda, S.; Zhu, X.-K.; Meija, J.; Pure Appl. Chem. 2022, 94, 573. [Crossref] 19. Bureau International des Poids et Mesures (BIPM); The International System of Units, 9ª ed.; BIPM: Paris, 2019 (versão 3.01, agosto de 2024). [Link] acessado em maio 2025 20. O Sistema Internacional de Unidades (SI), 9ª ed., trad. Grupo de Trabalho Luso-Brasileiro do Inmetro e IPQ; Inmetro: Brasília, 2021. [Link] acessado em maio 2025 21. Chem. Int. 2025, 47, 20. [Crossref] 22. Standard Atomic Weights 2024, https://www.ciaaw.org/atomic-weights.htm, acessado em maio 2025. 23. Rocha-Filho, R. C.; Chagas, A. P.; Quim. Nova 1999, 22, 769. [Link] acessado em maio 2025 24. Dicionário da Língua Portuguesa - Academia Brasileira de Letras, https://servbib.academia.org.br/dlp, acessado em maio 2025. 25. Holden, N. E.; Martin, R. L.; Pure Appl. Chem. 1983, 55, 1101. [Crossref] 26. Holden, N. E.; Martin, R. L.; Pure Appl. Chem. 1984, 56, 653. [Crossref] 27. Wieser, M. E.; Berglund, M.; Pure Appl. Chem. 2009, 81, 2131. [Crossref] 28. Meija, J.; Coplen, T. B.; Berglund, M.; Brand, W. A.; De Bièvre, P.; Gröning, M.; Holden, N. E.; Irrgeher, J.; Loss, R. D.; Walczyk, T.; Prohaska, T.; Pure Appl. Chem. 2016, 88, 265. [Crossref] 29. Lançada a Versão 2025 da Tabela Periódica Digital da SBQ, 2025, https://boletim.sbq.org.br/noticias/2025/n4110.php, acessado em maio 2025. 30. Monoisotopic Elements, https://www.ciaaw.org/monoisotopic-elements.htm, acessado em maio 2025. 31. Periodic Table of Elements, https://iupac.org/what-we-do/periodic-table-of-elements, acessado em maio 2025. 32. Radioactive Elements, https://www.ciaaw.org/radioactive-elements.htm, acessado em maio 2025. 33. Cohen, E. R.; Cvitaš, T.; Frey, J. G.; Holmström, B.; Kuchitsu, K.; Marquardt, R.; Mills, I.; Pavese, F.; Quack, M.; Stohner, J.; Strauss, H. L.; Takami, M.; Thor, A. J.; Grandezas, Unidades e Símbolos em Físico-Química, trad. Rocha-Filho, R. C.; Fausto, R., coords.; Sociedade Brasileira de Química: São Paulo, 2018. [Link] acessado em maio 2025 34. Brett, C. M. A.; Frey, J. G.; Hinde, R.; Kuroda, Y.; Marquardt, R.; Pavese, F.; Quack, M.; Stohner, J.; Thor, A. J.; Quantities, Units and Symbols in Physical Chemistry, 4th ed., versão abreviada; IUPAC / Royal Society of Chemistry: Londres, 2023. [Link] acessado em maio 2025 35. Mohr, P. J.; Newell, D. B.; Taylor; B. N.; Tiesinga, E.; Rev. Mod. Phys. 2025, 97, 025002. [Crossref] 36. Rumble, J.; CRC Handbook of Chemical Physics, 105th ed.; CRC Press: Boca Raton, 2024. 37. Kramida, A.; Ralchenko, Yu.; Reader, J.; NIST ASD Team; NIST Atomic Spectra Database, versão 5.12 [Online]; National Institute of Standards and Technology: Gaithersburg, 2024. [Crossref] 38. Emsley, J.; The Elements, 3rd ed.; Oxford University Press: New York, 1998. 39. Mohr, F.; Gold Bull. 2004, 37, 164. [Crossref] 40. Standard Atomic Weights of Three Technology Critical Elements Revised, https://iupac.org/standard-atomic-weights-of-three-technology-critical-elements-revised, acessado em maio 2025. 41. Extended Periodic Table, https://en.wikipedia.org/wiki/Extended_periodic_table, acessado em maio 2025. 42. Reedijk, J.; Polyhedron 2018, 141, 1. [Crossref] 43. Bourzac, K.; Nature 2024, 632, 16. [Crossref] 44. Heinz, S.; Physics 2024, 17, 150. [Crossref] 45. File:Pt172expanded.svg, https://commons.wikimedia.org/wiki/File:Pt172expanded.svg, acessado em maio 2025. 46. Melo Filho, J. M.; Faria, R. B.; Quim. Nova 1990, 13, 53. [Link] acessado em maio 2025 47. Tolentino, M.; Rocha-Filho, R. C.; Chagas, A. P. Quim. Nova 1997, 20, 103. [Link] acessado em maio 2025 48. de Lima, G. M.; Barbosa, L. C. A.; Filgueiras, C. A. L.; Quim. Nova 2019, 42, 1125. [Crossref] 49. Tolentino, M.; Rocha-Filho, R. C.; Quim. Nova 1994, 17, 182. [Link] acessado em maio 2025 50. Leite, H. S. A.; Porto, P. A.; Quim. Nova 2015, 38, 580. [Link] acessado em maio 2025 51. Leite, B. S.; Quim. Nova 2019, 42, 702. [Crossref] 52. Toma, H. E.; Quim. Nova 2019, 42, 468. [Crossref] Em relação a este artigo, cabe destacar tabelas periódicas originais nele mencionadas, uma das quais contempla distribuição isotópica (algo útil para a discussão de espectros de massa), disponíveis neste link: https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=1071.
#Membro da Comissão de Curadoria das Tabelas Periódicas da Sociedade Brasileira de Química (CCTP/SBQ) Editor responsável pelo artigo: Jorge M. David |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access