Educação
|
|
| Uma simulação de caso para investigação de vestígios: análise de adulterantes de cocaína em impressões digitais utilizando a técnica do pó e espectrometria de massas A case simulation for trace investigation: analysis of cocaine adulterants in fingerprints using the powder technique and mass spectrometry |
|
Paula F. FilodaI,* I. Laboratório de Inovação e Soluções em Química, Centro de Ciências Químicas, Farmacêuticas e de Alimentos, Universidade Federal de Pelotas, 96900-010 Pelotas - RS, Brasil Recebido: 19/12/2024 *e-mail: paulaffiloda@gmail.com A simulation of traces extracted from surfaces such as glass, associated with fingerprints contaminated with drug residues, was proposed in this study. For this purpose, a silicone mold was created to replicate the papillary lines present in a fingerprint. The mold was then exposed to an oily mixture of fatty acids and cocaine adulterants, such as caffeine and benzocaine, to simulate the endogenous and exogenous chemical composition of the fingerprints. The residues left on the surfaces by the fingerprints, along with the silicone mold, were extracted and their chemical components were qualitatively identified in a single chromatogram using gas chromatography-mass spectrometry (GC-MS). This approach provided a didactic opportunity to explore the chemistry behind fingerprints within the context of forensic science education. INTRODUÇÃO As impressões digitais desempenham um papel importante em investigações de vestígios forenses substanciais, pois atuam como uma ferramenta primária na identificação de autoria humana em diversos tipos de crimes.1 As marcas digitais consistem em um desenho papilar epidérmico que apresenta tipos fundamentais e diversas minúcias, as quais auxiliam no processo de identificação humana. Esse estudo é abordado por uma área específica da criminalística, a papiloscopia, dedicada exclusivamente à análise dos desenhos das digitais para fins de identificação.2,3 As impressões digitais podem ser visíveis, exibindo detalhes identificáveis a partir das papilas dos dedos quando estes estão contaminadas com alguma substância, como sangue, sujeira ou gordura. Entretanto, as impressões digitais também podem ser invisíveis a olho nu, as chamadas impressões digitais latentes, compostas pelas secreções naturais da pele humana. As impressões digitais latentes estão entre as mais comumente encontradas em cenas de crimes e, por serem invisíveis, necessitam ser reveladas com reagentes específicos para que possam ser visualizadas.3 Nesse sentido, existem diversas técnicas e reagentes para a revelação de impressões digitais latentes, como spray de ninidrina, vapor de iodo, nitrato de prata e a técnica do empoamento, sendo cada uma delas efetiva para diferentes superfícies.4 No entanto, devido à simplicidade e eficácia do uso de pós reveladores, essa técnica tem sido a mais amplamente empregada. Embora haja algumas limitações quanto ao uso em certos tipos de superfícies, os pós tradicionalmente utilizados pela técnica do empoamento podem ser prejudiciais à saúde dos profissionais em função da toxicidade, além de apresentarem altos custos, pois comumente são adquiridos via importações, bem como podem dificultar a visualização das minúcias das impressões digitais por serem limitados a determinados tipos de superfícies.4,5 Tais circunstâncias têm fomentado diversos estudos do nosso grupo de pesquisa, visando desenvolver reveladores de impressões digitais que possuam pouca ou nenhuma toxicidade e uma aderência mais eficaz aos diferentes tipos de superfícies, sintetizados para atuar como análogos de substâncias naturais, apresentando estrutura química semelhante.5-10 As características do doador, como idade, medicação, saúde, dieta, entre outras, os contaminantes exógenos, como umidade e temperatura, e fatores de deposição, como duração do contato e a área da ponta do dedo em contato com a superfície, bem como a própria natureza da superfície, são algumas das muitas variáveis que podem influenciar a composição de uma impressão digital latente.11,12 Os lipídios, componentes presentes em abundância nas marcas digitais sebáceas, desempenham um papel crucial na pesquisa em ciência forense. Entre esses lipídios estão triglicerídeos, esqualeno, ésteres de cera, colesterol e ácidos graxos, compostos que são alvos importantes para técnicas de aprimoramento e também podem ser úteis no desenvolvimento de metodologias para datação das marcas de dedos.13 Além dos compostos oleosos, as impressões digitais podem conter outros elementos, como aminoácidos, proteínas, ureia, ácido lático, açúcares e íons inorgânicos.12 Alguns contaminantes também podem estar presentes na sua composição, como cosméticos, resíduos de alimentos, medicamentos, e drogas ilícitas e seus metabólitos.14 Deste modo, o contato de um indivíduo com drogas ilícitas, por exemplo, é uma informação relevante na composição química dos vestígios de impressões digitais latentes, podendo orientar a condução de uma investigação policial.15 A cocaína é uma das drogas ilícitas mais traficadas no Brasil e em diversos outros países, sendo um dos principais problemas de saúde pública, devido ao seu impacto social e toxicológico tanto para os usuários quanto para a sociedade.16 Comercializada de forma ilícita e frequentemente adulterada com substâncias de baixo custo e de fácil obtenção, como amido de milho, bicarbonato, açucares, além de adulterantes como lidocaína, benzocaína e cafeína, que potencializam seus efeitos, a cocaína tem seu valor superestimado no comércio ilegal.17,18 Em geral, compostos como ácidos graxos, cocaína e seus adulterantes estão entre os componentes analisados em vários estudos sobre a composição química de impressões digitais latentes. A cromatografia gasosa acoplada a espectrometria de massa (CG-EM) é umas das técnicas analíticas mais empregadas para esse fim.11,19,20 No entanto, esta técnica requer compostos que sejam voláteis e termicamente estáveis para análise, o que faz com que compostos orgânicos, como os ácidos graxos, não possam ser analisados diretamente. A presença de grupos funcionais, como carboxila e hidroxila, confere a estas moléculas propriedades físico-químicas, como baixa volatilidade e instabilidade térmica, alta polaridade e solubilidade em água. Diante disso, é necessário utilizar uma etapa de derivatização antes da análise cromatográfica, a fim de converter os compostos de interesse em derivados adequados para a análise.21,22 Uma das reações mais comumente utilizadas para derivatizar ácidos graxos livres é a conversão desses compostos em ésteres metílicos, por meio da reação de esterificação, na qual o hidrogênio ativo dos ácidos carboxílicos é substituído por um grupo alquil. Esse processo reduz a polaridade dos derivados e aumenta sua estabilidade térmica. Para esse propósito, uma ampla variedade de rotas de síntese pode ser empregada, como a esterificação química direta de ácidos graxos livres com álcoois, na presença de catalisadores inorgânicos, sendo os mais comuns o ácido clorídrico ou ácido sulfúrico.23 Alternativamente, a síntese direta de ésteres metílicos a partir de ácidos graxos e álcoois também pode ser realizada por processos enzimáticos24 ou utilizando líquidos iônicos,25 embora essas abordagens exijam mais tempo e apresentem alto custo.26-28 Dessa forma, o objetivo deste trabalho é avaliar micros vestígios extraídos de impressões digitais latentes deixadas em superfícies de vidro, em um cenário simulado de crime representado por um laboratório clandestino. Para isso, a deposição das impressões digitais será realizada utilizando um molde de silicone, o qual replicará tanto os componentes endógenos quanto exógenos presentes nas digitais. As impressões digitais serão reveladas utilizando a técnica do pó e, em seguida, a cromatografia gasosa acoplada à espectrometria de massas (CG-EM) será empregada para identificar e caracterizar os componentes químicos presentes nas impressões digitais simuladas.
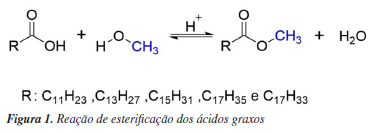
PARTE EXPERIMENTAL Preparação do molde para simulação de impressões digitais A confecção do molde iniciou-se com o acondicionamento da massa de modelar (Massinha SOFT, Acrilex) sobre uma superfície de vidro, seguida pela pressão do dedo polegar direito de um doador sobre a massa, de maneira a modelar a impressão digital com uma boa definição das linhas papilares.29 Após a formação do molde, a resina de borracha de silicone (Azul PS, Fiberglass) foi preparada conforme as especificações do fabricante, misturando a resina com o catalisador até a obtenção de uma mistura homogênea e sem segregação de fases. Em seguida, a mistura foi despejada sobre o molde de massa de modelar, garantindo seu preenchimento completo. O conjunto foi mantido por 48 h em um dessecador sob vácuo para secagem, a fim de evitar a formação de bolhas de ar. Após esse período, a estrutura de silicone, simulando o dedo com a impressão digital, foi cuidadosamente removida do molde. Síntese dos ésteres de ácidos graxos Os principais ácidos graxos foram selecionados com base em estudos anteriores30 realizados pelo grupo de pesquisa, que caracterizaram o perfil de ácidos graxos presentes em impressões digitais latentes. Desta forma, os padrões analíticos dos principais ácidos graxos, como ácido láurico (C12:0), ácido mirístico (C14:0), ácido palmítico (C16:0), ácido esteárico (C18:0) e ácido oleico (C18:1), foram transformados em seus respectivos ésteres metílicos por meio de uma reação de esterificação simples, conduzida à temperatura ambiente e em curto tempo de reação, conforme metodologia desenvolvida pelo grupo.31 A reação de esterificação foi realizada individualmente para cada ácido graxo. Em um béquer, foram misturados 4,0 mmol do ácido graxo com 16,8 mL de metanol e 2,0 mmol de ácido sulfúrico como catalisador, de acordo com o esquema ilustrado na Figura 1. A solução foi sonicada por 15 min em temperatura ambiente (25 ºC). Na sequência, o álcool foi evaporado sob pressão reduzida, e o resíduo obtido foi dissolvido em 35 mL de éter etílico e lavado com água (3 × 20 mL). As frações orgânicas foram combinadas e secas com sulfato de magnésio (MgSO4), e o solvente foi evaporado sob vácuo, obtendo-se os ésteres de ácidos graxos puros. Com base nas proporções descritas na literatura, os volumes de cada éster foram calculados para preparar uma mistura oleosa no volume final de 200 µL. Nesta mistura, também foram adicionados 10 µL do padrão analítico esqualeno, uma vez que este composto se encontra naturalmente na composição das células, sendo precursor da biossíntese do colesterol.
Simulação e análise do laboratório clandestino O cenário desenvolvido para esta pesquisa simulou uma situação em que um indivíduo manuseou drogas em um laboratório clandestino e deixou suas impressões digitais em diferentes superfícies do local. Para este cenário, os elementos representativos do laboratório foram dispostos conforme ilustrado na Figura 2, com todos os vestígios devidamente marcados. A impressão digital foi simulada ao depositar 10 µL de uma mistura oleosa, previamente preparada, sobre o dedo de molde de silicone, também previamente confeccionado. Após a secagem da mistura, foi pulverizado um grama do pó contendo quantidades iguais dos adulterantes da cocaína: benzocaína e cafeína.
O dedo molde foi pressionado sobre uma superfície de vidro, de modo a transferir a impressão digital contendo a mistura oleosa e os adulterantes da cocaína. Após a deposição, a revelação da impressão digital foi realizada utilizando um pó revelador desenvolvido pelo nosso grupo de pesquisa para aplicação forense, composto por chalcona fluorescente.32 A coleta dos vestígios foi realizada com o uso de um swab, consistindo em um cotonete previamente umedecido com solvente extrator (clorofórmio). O cotonete foi esfregado sobre a superfície de vidro, de maneira a coletar o resíduo da impressão digital, juntamente com o pó revelador. Em seguida, o cotonete foi colocado dentro de um Eppendorf, o qual foi armazenado em um saco de evidências devidamente identificado. O processo de deposição, revelação e coleta das impressões digitais é ilustrado na Figura 3.
Extração da composição das impressões digitais e análise cromatográfica A extração dos componentes químicos presentes nas impressões digitais geradas a partir do molde de silicone foi realizada adicionando-se 1 mL de clorofórmio a um Eppendorf contendo o material coletado pelo swab. Em seguida, o Eppendorf foi fechado e agitado em um misturador vórtex por 30 s para extração dos compostos. Após a extração, o material foi transferido para um vial utilizando-se uma pipeta de Pasteur de vidro com um algodão na extremidade, permitindo a filtração do material antes da análise cromatográfica. A análise cromatográfica foi realizada em um cromatógrafo a gás Shimadzu QP 2020 Plus, equipado com injetor automático AOC-20i e detector por espectrometria de massas (CG-EM). Foi utilizado uma coluna Rtx-5MS (30 m × 0,25 mm × 0,25 μm), com temperatura inicial fixada em 100 ºC, que foi aumentada a uma taxa de 80 ºC min-1 até atingir 250 ºC, mantendo-se nessa temperatura por 5 min. A injeção foi realizada no modo split (1:50), com volume de 1 μL. O gás carregador foi hélio, com fluxo de 1,20 mL min-1. A interface e o detector foram mantidos a 200 ºC. A identificação dos compostos extraídos, incluindo ésteres metílicos de ácidos graxos, esqualeno, cafeína e benzocaína, foi realizada por comparação dos espectros obtidos com a biblioteca NIST (do inglês, National Institute of Standards and Technology) 2017.
RESULTADOS E DISCUSSÃO A Figura 4 apresenta o molde de silicone confeccionado para o desenvolvimento deste estudo, evidenciando as linhas papilares da impressão digital com boa definição. A utilização de um molde de silicone no formato do dedo foi escolhida para simular as características de uma impressão digital, ao mesmo tempo em que preserva a privacidade e a segurança dos alunos. Para a confecção do molde, recomenda-se o uso da impressão digital de um professor ou outro membro da equipe de pesquisa, evitando a exposição dos alunos. Essa abordagem também elimina o risco de exposição direta dos alunos a substâncias químicas durante o experimento, assegurando tanto a qualidade dos resultados quanto o bem-estar dos envolvidos.

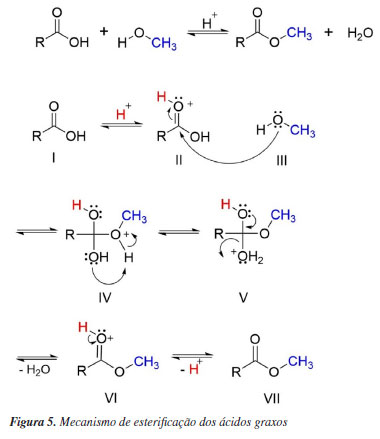
A composição química das impressões digitais é uma mistura complexa de compostos orgânicos, endógenos e inorgânicos, podendo conter contaminantes exógenos, como cosméticos, resíduos alimentares, medicamentos e drogas ilícitas. Essa composição é influenciada por diversos fatores, incluindo as características individuais do doador (como estilo de vida, idade e ocupação), as condições ambientais e tipos de substrato onde a impressão digital é depositada. Em função disso, há uma grande variabilidade na composição química das impressões digitais, o que dificulta a reprodutibilidade dos resultados obtidos em estudos científicos.11,12,19 Para abordar a relação entre ciência forense e química orgânica neste estudo, optou-se por preparar uma mistura oleosa contendo alguns dos principais ácidos graxos comumente presentes nas impressões digitais. No entanto, em uma análise de uma situação real, os ácidos graxos extraídos das marcas digitais precisam ser derivatizados para serem analisados por CG-EM. Essa derivatização é necessária devido à presença do hidrogênio ativo na hidroxila da estrutura desses compostos, que pode participar de diversas interações intermoleculares. Tais interações frequentemente prejudicam o processo de separação cromatográfica, resultando em fenômenos indesejáveis de adsorção entre interações da hidroxila do analito com as superfícies internas do injetor e/ou da coluna do cromatógrafo. Assim, derivando o grupo hidroxila dos ácidos graxos, aumenta sua volatilidade e estabilidade, melhorando as propriedades de separação e detecção desses compostos durante a análise cromatográfica.33 Desta forma, a mistura oleosa foi preparada contendo os ácidos graxos já nas suas respectivas formas derivatizadas, ou seja, na forma de ésteres, permitindo a abordagem da síntese desses compostos neste trabalho. Os ácidos graxos foram derivatizados por meio de uma reação de esterificação, empregando metanol (álcool de cadeia curta) como agente derivatizante na presença de ácido sulfúrico como catalisador. Esse processo permitiu a modificação estrutural dos ácidos graxos, resultando em ésteres correspondentes, compostos com menor polaridade e maior estabilidade térmica. Na reação de esterificação, inicialmente, ocorre a protonação da carbonila (I) pela doação de um próton do ácido. Em seguida, com a carbonila protonada (II), a carga parcial positiva no carbono da carbonila aumenta, fazendo com que o oxigênio do álcool (III) ataque o carbono da carbonila (II), resultando na formação de um intermediário tetraédrico (IV). Depois, a hidroxila do intermediário captura o hidrogênio ácido do oxigênio da molécula (IV), promovendo a estabilização dessa estrutura. Seguidamente, ocorre um rearranjo na qual a água (H2O) é eliminada (V), resultando na formação da carbonila protonada (VI). Finalmente, há a eliminação do hidrogênio ligado ao oxigênio da carbonila, levando à estabilização da carbonila e à formação do éster (VII). O mecanismo da reação de esterificação dos ácidos graxos foi adaptado e está representado no esquema da Figura 5.34
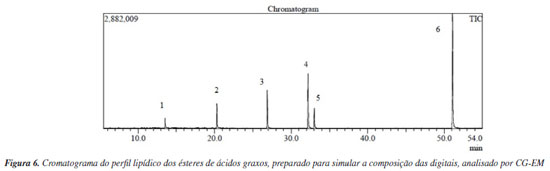
Após a obtenção dos ésteres purificados de cada um dos ácidos graxos, a mistura oleosa foi preparada por meio da combinação das diferentes proporções dos ésteres, conforme descrito na subseção “Síntese dos ésteres de ácidos graxos". A partir da impressão digital formada com o molde de silicone, foi realizada a extração do material, seguida da análise no CG-EM, com o objetivo de verificar se o perfil dos ácidos graxos selecionados seria reproduzido na análise. A Figura 6 apresenta o cromatograma dos ésteres dos ácidos graxos extraídos da impressão digital gerada com o dedo molde de silicone contendo a mistura oleosa. As proporções dos ácidos graxos, de acordo com a literatura, foram corretamente reproduzidas. A maior intensidade no cromatograma refere-se aos ésteres metílicos dos ácidos palmítico (3), seguido pelo ácido oleico (4), ácido esteárico (5), ácido mirístico (2) e ácido láurico (1), respectivamente. O pico identificado como (6) corresponde ao esqualeno.
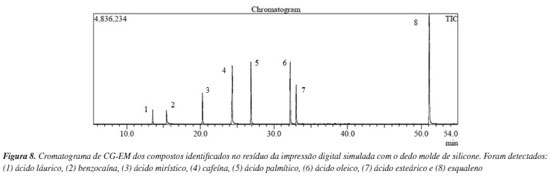
Ácidos graxos de cadeia longa, como ácido tetradecanoico, ácido palmitoleico, ácido palmítico, ácido oleico e ácido esteárico são normalmente encontrados em impressões digitais, com variações na frequência de sua presença entre diferentes doadores.35 As proporções variáveis de ésteres metílicos de ácidos graxos contribuem para a criação de um perfil único de cada indivíduo, permitindo classificações baseadas em gênero e raça, com base no perfil químico obtido.36 O ácido graxo palmítico é geralmente um dos compostos endógenos mais abundantes em resíduos de impressões digitais, seguido do esqualeno.11 Em um estudo sobre a composição química das impressões digitais depositadas em superfícies de vidro para fins de determinação de gênero, foram identificados onze compostos, incluindo ácidos graxos, ésteres metílicos de ácidos graxos, colesterol e esqualeno.37 No estudo de Poletti et al.,30 o perfil de ácidos graxos de impressões digitais latentes sebáceas foi investigado, demonstrando que as amostras eram compostas principalmente de ácidos graxos variando de C12 a C24, com os ácidos mais abundantes nas marcas de dedos sendo o ácido palmítico (C16:0), o ácido oleico (C18:1), o ácido mirístico (C14:0) e o ácido esteárico (C18:0). Consequentemente, as impressões digitais, após simulação da composição endógena e contaminação com adulterantes da cocaína, foram reveladas com o pó chalcona fluorescente, desenvolvido pelo nosso grupo. A técnica mostrou-se eficaz, evidenciando as impressões nas superfícies simuladas. A técnica de revelação de impressões digitais latentes por pós caracteriza-se por ser um método físico, onde as partículas do pó aderem ao material lipofílico da impressão digital, enquanto as demais partículas do resíduo da digital se ligam por forças de van der Waals com as partículas do pó, desde que estejam suficientemente próximos.38 A Figura 7 apresenta o resultado da revelação, com o pó aderindo adequadamente ao material lipofílico das impressões digitais, proporcionando um bom nível de detalhamento. A interação eficaz do pó revelador com as cristas presentes na impressão digital simulada com o molde de silicone sugere que essa impressão poderia, possivelmente, ser usada para identificar um suposto indivíduo em uma cena de crime. O material empregado para a revelação da impressão digital latente deste estudo apresenta baixa toxicidade, viabilizando sua utilização em laboratório de forma segura para os alunos. Após a revelação das impressões digitais, foi realizada uma nova extração, incluindo todos os resíduos presentes na impressão digital, como os ácidos graxos, o esqualeno, os adulterantes de cocaína (cafeína e benzocaína) e o pó revelador. Assim, foi possível observar na análise por CG-EM, qualitativamente, e em um único cromatograma (Figura 8), a presença e identificação dessas substâncias, evidenciando os vestígios deixados no local de crime simulado, um laboratório clandestino.
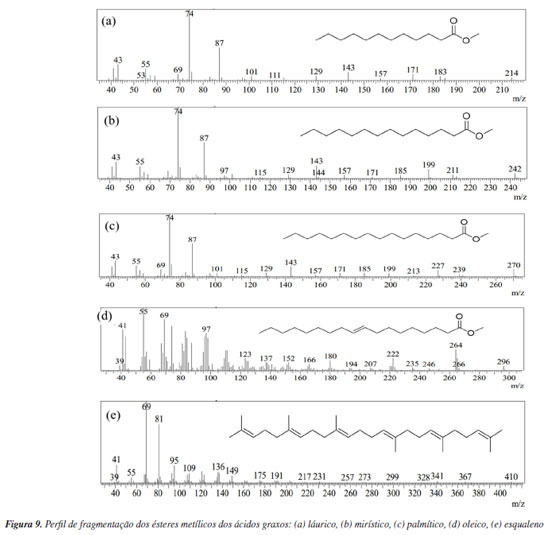
A cromatografia a gás é um dos métodos mais utilizados para investigações da fração lipídica de impressões digitais, sendo uma das técnicas mais difundidas dentro das ciências forenses.11,39 Trata-se de um método físico-químico empregado na separação de compostos voláteis e termoestáveis de uma amostra, que são separados baseados na diferente distribuição dos mesmos entre a fase estacionária líquida (imobilizada na superfície da coluna) e uma fase móvel gasosa. A programação da temperatura na coluna contribui para separação dos componentes devido a características como, volatilidade, ponto de ebulição, peso molecular e estabilidade térmica.39,40 Compostos mais voláteis eluem mais rapidamente da coluna cromatográfica, apresentando menores tempos de retenção ao passo que componentes com maiores pontos de ebulição eluem menos rapidamente, apresentando maiores valores de tempo de retenção. Cada espécie separada conforme a sua afinidade físico-química com a fase estacionária, é eluída seletivamente a um sistema de detecção, nesse caso, o espectrômetro de massas (EM), o qual permite a identificação de um composto pela comparação de seu espectro de massas a uma biblioteca ou por identificação da estrutura a partir de seus fragmentos.41 O princípio da EM é a ionização de uma molécula, onde seus íons são separados pela razão massa/carga (m/z) e cada fração numérica é registrada em um cromatograma de massas tendo o tempo de retenção da eluição de cada composto e a intensidade do sinal.42 As moléculas da amostra na fase gasosa são bombardeadas com elétrons de alta energia (geralmente 70 eV), removendo um elétron da estrutura, formando um cátion radical também conhecido como íon molecular M+, estrutura com elétron desemparelhado. Na sequência, o excesso de energia que é adicionado ao cátion radical recém-criado é tão grande que leva a quebra das ligações covalentes em fragmentos característicos do composto, formando o espectro de massas e, por isso, nem sempre é possível reconhecer o fragmento do íon molecular. O pico mais intenso do espectro de massas é chamado de pico base e tem arbitrariamente a intensidade 100%, enquanto que as intensidades dos demais picos, aparecem na forma de percentagens do pico base. O pico do íon molecular (o de massa mais alta) pode ser, eventualmente, o pico base.43 A Figura 9 apresenta os respectivos espectros de massas com padrão de fragmentação característico para os componentes da mistura oleosa (ésteres de ácidos graxos e esqualeno).
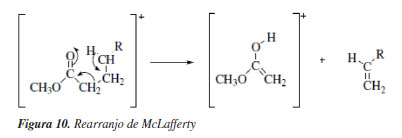
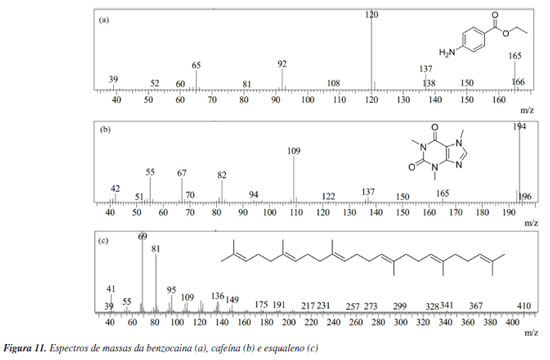
Para fins de exemplificação e didáticos, foi feita uma discussão de como analisar o espectro de massas do ácido graxo mirístico, no caso da estrutura derivatizada, éster metílico do ácido mirístico, a qual apresentou 97% de similaridade com o padrão de fragmentação da biblioteca NIST 2017, cujos principais íons de referência foram 74 (100%); 87 (55%); 43 (23%) e ainda o fragmento do íon molecular correspondente a massa molecular do composto M+ 242. O pico mais característico dos ésteres graxos é devido ao rearranjo de McLafferty com quebra da ligação β em relação ao grupo C=O (Figura 9). Assim, o éster metílico de um ácido graxo alifático não ramificado no carbono α produz um pico mais intenso em m/z 74, que é o pico base dos ésteres metílicos de cadeia linear na faixa de C6 a C26, correspondente ao fragmento CH2COOHCH3.43 A Figura 11 apresenta os respectivos espectros de massas com padrão de fragmentação característico dos componentes exógenos das impressões digitais, sendo eles a cafeína (Figura 11a) e benzocaína (Figura 11b). Para fins de exemplificação, foi feita uma discussão de como analisar o espectro de massas da cafeína, que apresentou 97% de similaridade com o padrão de fragmentação da biblioteca NIST 2017, onde o pico m/z 194 corresponde ao íon de maior intensidade referente ao íon molecular M+ da cafeína o qual também representa a massa molar do composto (194,15 g mol-1). No espectro de massas da cafeína, três íons caracterizam a molécula, sendo eles m/z 194, 109 e 67, cujas abundâncias características foram 100, 57 e 29%, respectivamente.44 A Tabela 1 apresenta a descrição de todos os compostos analisados no CG-EM.
A Química Forense exemplifica a aplicação da química no contexto da investigação criminal, sendo um tema que desperta a curiosidade da maioria dos alunos, podendo ser empregada de maneira empolgante no ensino da química, estabelecendo conexões entre a teoria e a prática.45 Desta forma, sugerimos com este estudo, uma abordagem experimental que pode ser reproduzida em laboratório de maneira a auxiliar os alunos na contextualização de uma situação real forense envolvendo conceitos químicos por trás das digitais.
CONCLUSÕES O experimento proposto neste estudo pode ser implementado no ensino de Química em cursos de graduação e técnicos, além do curso de Farmácia. A abordagem proposta oferece conteúdos para explorar estudos alinhados com a papiloscopia forense, química orgânica (síntese de ésteres), impressões digitais, adulterantes de cocaína e cromatografia a gás e espectrometria de massas, em um contexto de aplicação em ciências forenses. Assim, foi possível simular vestígios de um suposto local de crime, sendo coletadas impressões digitais latentes obtidas por meio de um molde de silicone, o qual teve uma composição lipídica e presença de resíduos de substâncias químicas, simulando uma impressão digital latente real. Desta forma, compostos como ésteres metílicos de ácidos graxos, esqualeno, cafeína e benzocaína foram qualitativamente identificados e visualizados simultaneamente em um único cromatograma empregando a técnica CG-EM. Desse modo, esse estudo fornece uma possibilidade aos alunos de explorarem alguns dos principais conceitos relacionados a identificação de compostos por meio da CG-EM, como espectros de massas resultantes, íon molecular e perfil de fragmentação.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados estão disponíveis no texto.
AGRADECIMENTOS Agradecemos a Universidade Federal de Pelotas (UFPel) e aos órgãos de fomento Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Fundação de Amparo à Pesquisa do Estado do Rio Grande do Sul (FAPERGS, projeto 22/2551-0001050-4) e ao Instituto Nacional de Ciência e Tecnologia (INCT) Forense (projeto 465450/2014-8).
REFERÊNCIAS 1. Figini, A. R.; Datiloscopia e Revelação de Impressões Digitais, 1a ed.; Millennium: Campinas, 2012. 2. Velho, J. A.; Geiser, G. C.; Espindula, A.; Ciências Forenses: Uma Introdução às Principais Áreas da Criminalística Moderna, 3ª ed.; Millenium: Campinas, 2017. 3. Leitzke, A. F.; Berneira, L. M.; Rosa, B. N.; Moreira, B. C.; Mariotti, K. C.; Venzke, D.; Pereira, C. M.; Quim. Nova 2022, 45, 424. [Crossref] 4. Garg, R. K.; Kumari, H.; Kaur, R.; Egyptian Journal of Forensic Sciences 2011, 1, 53. [Crossref] 5. Pacheco, B. S.; da Silva, C. C.; da Rosa, B. N.; Mariotti, K. C.; Nicolodi, C.; Poletti, T.; Segatto, N. V.; Collares, T.; Seixas, F. K.; Paniz, O.; Chem. Pap. 2021, 75, 3119. [Crossref] 6. Balsan, J. D.; Rosa, B. N.; Pereira, C. M.; Santos, C. M.; Quim. Nova 2019, 42, 845. [Crossref] 7. Poletti, T.; Berneira, L. M.; Bueno, D. T.; da Silva, C. C.; da Silva, R.; Pereira, C. M.; Talanta Open 2022, 6, 100133. [Crossref] 8. da Rosa, B. N.; da Rosa, M. P.; Poletti, T.; de Lima, N. P. K.; Maron, G. K.; Lopes, B. V.; Mariotti, K. C.; Beck, P. H.; Carreno, N. L. V.; de Pereira, C. M. P.; Surfaces 2022, 5, 481. [Crossref] 9. Lima, N. P.; Rosa, B. N.; Poletti, T.; Moreira, B. C.; Leitzke, A. F.; Mariotti, K. C.; Carreño, N. L.; Pereira, C. M.; Quim. Nova 2023, 46, 215. [Crossref] 10. Venzke, D.; Poletti, T.; Rosa, B. N.; Berneira, L. M.; de Lima, N. P.; de Oliveira, T. F.; Carreño, N. L.; Mariotti, K. C.; Duarte, L. S.; Nobre, S. M.; Chem. Data Collect. 2021, 33, 100680. [Crossref] 11. Frick, A.; Chidlow, G.; Lewis, S.; Van Bronswijk, W.; Forensic Sci. Int. 2015, 254, 133. [Crossref] 12. Weyermann, C.; Roux, C.; Champod, C.; J. Forensic Sci. 2011, 56, 102. [Crossref] 13. Girod, A.; Weyermann, C.; Forensic Sci. Int. 2014, 238, 68. [Crossref] 14. Girod, A.; Ramotowski, R.; Weyermann, C.; Forensic Sci. Int. 2012, 223, 10. [Crossref] 15. Jang, M.; Costa, C.; Bunch, J.; Gibson, B.; Ismail, M.; Palitsin, V.; Webb, R.; Hudson, M.; Bailey, M.; Sci. Rep. 2020, 10, 1974. [Crossref] 16. Pinho, I. V.; Rodrigues, F. D. J.; Zambon, G.; Novos Estudos CEBRAP 2023, 42, 41. [Crossref] 17. Macedo, D. F.; Nascimento, P. S.; Santana, A. J.; Coelho, V. A. T.; de Araújo, L. B. S.; Coelho, T.; de Souza, C. G.; Nascimento, E. S.; de Oliveira Machado, A. L.; Bigatello, C. S.; Ciências Biológicas e da Saúde: Integrando Saberes em Diferentes Contextos; de Oliveira, T. R. S.; Barbosa Neto, O., orgs.; Editora Científica Digital: São Paulo, 2022. [Crossref] 18. Żubrycka, A.; Kwaśnica, A.; Haczkiewicz, M.; Sipa, K.; Rudnicki, K.; Skrzypek, S.; Poltorak, L.; Talanta 2022, 237, 122904. [Crossref] 19. Cadd, S.; Mota, L.; Werkman, D.; Islam, M.; Zuidberg, M.; de Puit, M.; Anal. Methods 2015, 7, 1123. [Crossref] 20. van Helmond, W.; van Herwijnen, A. W.; van Riemsdijk, J. J.; van Bochove, M. A.; de Poot, C. J.; de Puit, M.; Forensic Chem. 2019, 16, 100183. [Crossref] 21. Farajzadeh, M. A.; Nouri, N.; Khorram, P.; TrAC, Trends Anal. Chem. 2014, 55, 14. [Crossref] 22. Frias, C. F.; Gramacho, S. A.; Pineiro, M.; Quim. Nova 2014, 37, 176. [Crossref] 23. Chai, M.; Tu, Q.; Lu, M.; Yang, Y. J.; Fuel Process. Technol. 2014, 125, 106. [Crossref] 24. Mahapatra, P.; Kumari, A.; Garlapati, V. K.; Banerjee, R.; Nag, A.; J. Mol. Catal. B: Enzym. 2009, 60, 57. [Crossref] 25. Weingärtner, H.; Angew. Chem., Int. Ed. 2008, 47, 654. [Crossref] 26. Pinto, A. C.; Guarieiro, L. L.; Rezende, M. J.; Ribeiro, N. M.; Torres, E. A.; Lopes, W. A.; Pereira, P. A. P.; Andrade, J. B.; J. Braz. Chem. Soc. 2005, 16, 1313. [Crossref] 27. Mori, N.; Togo, H.; Tetrahedron 2005, 61, 5915. [Crossref] 28. Gulati, R.; Arya, P.; Malhotra, B.; Prasad, A. K.; Saxena, R. K.; Kumar, J.; Watterson, A. C.; Parmar, V. S.; ARKIVOC 2003, 3, 159. [Crossref] 29. Pereira, C. M. P.; Machado, A. M.; Rosa, B. N.; Maron, G. K.; Rodrigues, L. S.; Poletti, T.; Carreno, N. L. V.; Lima, N. P. K.; Br 102022066108, 2022. 30. Poletti, T.; Berneira, L. M.; Passos, L. F.; da Rosa, B. N.; de Pereira, C. M.; Mariotti, K. C.; Sci. Justice 2021, 61, 378. [Crossref] 31. Hobuss, C. B.; Venzke, D.; Pacheco, B. S.; Souza, A. O.; Santos, M. A.; Moura, S.; Quina, F. H.; Fiametti, K. G.; Oliveira, J. V.; Pereira, C. M.; Ultrason. Sonochem. 2012, 19, 387. [Crossref] 32. da Rosa, B. N.; Maron, G. K.; Lopes, B. V.; Rocha, A. C. S.; Gatti, F. M.; Machado, J. O. A.; Barichello, J. M.; Mariotti, K. C.; Trossini, G. H. G.; Carreno, N. L. V.; Mater. Chem. Phys. 2023, 295, 127033. [Crossref] 33. Řimnáčová, L.; Hušek, P.; Šimek, P.; J. Chromatogr. A 2014, 1339, 154. [Crossref] 34. Pacheco, B. S.; Nunes, C. F.; Rockembach, C. T.; Bertelli, P.; Mesko, M. F.; Roesch-Ely, M.; Moura, S.; Pereira, C. M.; Green Chem. Lett. Rev. 2014, 7, 265. [Crossref] 35. Archer, N. E.; Charles, Y.; Elliott, J. A.; Jickells, S.; Forensic Sci. Int. 2005, 154, 224. [Crossref] 36. Michalski, S.; Shaler, R.; Dorman, F. L.; J. Forensic Sci. 2013, 58, S215. [Crossref] 37. Asano, K. G.; Buchanan, M.; Bayne, C.; Horsman, K.; J. Forensic Sci. 2002, 47, 1. [Crossref] 38. Chen, Q.; Kerk, W. T.; Soutar, A. M.; Zeng, X. T.; Appl. Clay Sci. 2009, 44, 156. [Crossref] 39. Nicolodi, C.; Rosa, B. N.; Silva, C. C.; Berneira, L. M.; Pacheco, B. S.; Poletti, T.; Venzke, D.; Mariotti, K. C.; Pereira, C. M.; Quim. Nova 2019, 42, 962. [Crossref] 40. Collins, C. H.; Braga, G. L.; Bonato, P. S.; Introdução a Métodos Cromatográficos, 3ª ed.; Editora da Unicamp: Campinas, 1988, p. 298. 41. Wei, Q.; Zhang, M.; Ogorevc, B.; Zhang, X.; Analyst 2016, 141, 6172. [Crossref] 42. Prestes, O. D.; Friggi, C. A.; Adaime, M. B.; Zanella, R.; Quim. Nova 2009, 32, 1620. [Crossref] 43. Silverstein, R.; Webster, F.; Kiemle, D.; Bryce, D.; Identificação Espectrométrica de Compostos Orgânicos, 7a ed.; Grupo Gen-LTC: Rio de Janeiro, 2006. 44. de Lima, I. M. H.; Frota, M. N.; Quim. Nova 2007, 30, 1820. [Crossref] 45. da Silva, J. N.; da Silva Amorim, J.; da Paz Monteiro, L.; Freitas, H. G.; Sci. Plena 2017, 13, 1. [Crossref]
Editor Associado responsável pelo artigo: Boniek G. Vaz |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access