Artigo
|
|
| Solvente eutético profundo para extração de cobre em amostras de chás e determinação por GF AAS Deep eutectic solvent for extraction of copper from tea samples and determination by GF AAS |
|
Eduardo da Silva Macedo; Caroline Gonçalves; Fabiana Luvizon Germer; Eduardo Sidinei Chaves* Departamento de Química, Universidade Federal de Santa Catarina, 88040-900 Florianópolis - SC, Brasil Recebido: 16/03/2025 *e-mail: eduardo.chaves@ufsc.br Tea is consumed worldwide and recognized for its health benefits due to the presence of bioactive compounds and micronutrients such as copper (Cu). This study proposes a method for determining Cu in tea by graphite furnace atomic absorption spectrometry and Box-Behnken design to obtain optimal extraction conditions using deep eutectic solvent (DES). The DES, composed of choline chloride and oxalic acid (1:1 molar ratio), was employed. The optimized temperature program for Cu determination used pyrolysis at 900 ºC and atomization at 2100 ºC. The best extraction conditions were found using 50 mg of sample, DES containing 20% (m m-1) of water and 45 min of ultrasound-assisted extraction at 60 ºC. The accuracy of the method was evaluated by analysis of certified reference materials (agreement from 95 to 112%) and the precision was assessed by the relative standard deviation (RSD < 10%, n = 3). The obtained limit of detection (0.2 mg kg-1) was suitable for analyzing teas. In the black, green and herbal teas analyzed, the total Cu concentration ranged from 2.5 to 35 mg kg-1 and the infusion extracted concentrations were up to 90%. Overall, the proposed method showed to be well-suited to determine the total and infusion extracted Cu concentrations in teas. INTRODUÇÃO O chá é uma das bebidas mais consumidas do mundo, possuindo grande valor cultural e econômico. Entre sua produção e o comércio, o chá movimenta anualmente, aproximadamente, 26 bilhões de dólares.1,2 O termo "chá" é amplamente utilizado para designar infusões preparadas com frutos, folhas, ervas e outros derivados de diversas plantas, no entanto, o chá tradicional refere-se, especificamente, à infusão preparada com as folhas desidratadas da planta Camellia sinensis, também conhecido como chá-da-índia. O chá tradicional pode ser classificado em três categorias que dependem do processo de produção: (i) preto, obtido por processo fermentativo, (ii) verde, obtido por processos não fermentativos, e (iii) Oolong, semi fermentado.3-5 A Camellia sinensis é rica em compostos bioativos, como catequinas e polifenóis, apresentando propriedades benéficas à saúde, além de propriedades relaxantes e antioxidantes que auxiliam na proteção celular.5,6 Contudo, no processo de infusão, elementos essenciais (Ca, Cu, Fe, Mg, Zn) e potencialmente tóxicos em níveis traço (As, Cd, Cr, Ni, Pb, Hg) podem ser extraídos e, dependendo da concentração destes elementos na infusão, podem apresentar riscos à saúde.7,8 A determinação de elementos essenciais e potencialmente tóxicos em chás é reportada na literatura,7 entretanto, a determinação de Cu em amostras de chás comercializados no Brasil ainda é limitada. Estudos apontam que altas concentrações de Cu em alimentos e na água pode estar relacionada à utilização agrícola de fungicidas contendo sulfato de cobre.7-9 Neste contexto, o monitoramento de Cu em alimentos contribui para a segurança alimentar, identificando possíveis contaminações resultantes de práticas agrícolas inadequadas.3,6,7,10 O Cu é um elemento essencial para o corpo humano, atuando na maturação dos tecidos linfoides e nas atividades proteicas.1,2,9 A presença natural e aceitável de Cu em alimentos é condicionada ao limite máximo de exposição diária, estabelecido pela Environmental Protection Agency (EPA),9,11 sendo para adultos a ingestão máxima permitida de até 1 mg de Cu por dia.12 No Brasil, o limite máximo permitido para concentração de Cu em águas destinadas ao consumo humano é de 2 mg L-1.12,13 Contudo, a exposição humana a concentrações elevadas de Cu pode ser tóxica, acarretando riscos à saúde.12,14,15 Assim, o monitoramento da concentração de metais como o Cu em chás é fundamental para o controle de qualidade e para a saúde dos consumidores. Diversas técnicas analíticas têm sido empregadas para a determinação de metais em amostras de chá,1,15 contudo, a espectrometria de absorção atômica com forno de grafite (GF AAS, graphite furnace atomic absorption spectrometry), oferece vantagens como o tratamento in situ de amostras por meio do programa de temperaturas, possibilitando a análise de amostras complexas e a obtenção de baixos limites de detecção (LOD). Entretanto, um preparo de amostras adequado, associado às técnicas analíticas específicas, é fundamental para garantir a qualidade dos resultados de uma análise química.7,16,17 Para a determinação de metais, o preparo de amostras utilizando decomposição ácida assistida por micro-ondas (MW-AD, microwave-assisted digestion) tem sido amplamente empregado para a análise de diferentes amostras.18,19 No entanto, a MW-AD apresenta limitações como o alto custo dos equipamentos e a utilização de solventes potencialmente tóxicos para a decomposição das amostras.20-22 Neste sentido, alternativas ambientalmente amigáveis, como a extração por meio do uso de solventes eutéticos profundos (DES, deep eutectic solvents), têm sido propostas. A aplicação dos DES como solventes extratores associados a determinação por GF AAS possibilita um preparo de amostra simples e rápido para a posterior quantificação de elementos em níveis traços.7,23 Os DES são formados pela mistura de dois ou mais componentes, sendo um aceptor de ligação de hidrogênio (HBA, hydrogen bond acceptor) e um ou mais doadores de ligação de hidrogênio (HBD, hydrogen bond donor), que apresentam ponto de fusão inferior ao dos seus constituintes individuais.23 Os DES foram relatados pela primeira vez na literatura por Abbott et al.23 como uma nova classe de líquidos iônicos na qual predominam ligações de hidrogênio. Entre as vantagens dos DES estão a simplicidade de obtenção, baixa reatividade em água, biodegradabilidade e baixa toxicidade.16,24 Além disso, a compatibilidade dos DES com diferentes técnicas analíticas (AAS, ICP OES (inductively coupled plasma optical emission spectrometry) e ICP-MS (inductively coupled plasma mass spectrometry) os torna uma alternativa interessante para o preparo de diferentes amostras para posterior determinação de metais.24-28 Os DES compostos por ácidos carboxílicos, especificamente os compostos por cloreto de colina e ácido oxálico (ChCl:Ox) têm sido utilizados para extração de Cu, Fe, e Zn em peixes,28 Pb em amostras biológicas26 e cascalhos de perfuração.27 Costa et al.25 utilizaram extração assistida por micro-ondas e DES formado por ChCl:Ox como solvente extrator para determinação de Cu em amostras de ervas medicinais. Dentre as diferentes técnicas de preparo de amostras reportadas na literatura,29 a utilização de solventes alternativos e ambientalmente amigáveis, como os DES tem se destacado, uma vez que vão ao encontro dos princípios da química verde (QC, green chemistry) e da química analítica verde (GAC, green analytical chemistry). Além disso, quando comparada às técnicas tradicionais de preparo de amostras, as quais geralmente fazem uso de ácidos fortes concentrados, solventes potencialmente tóxicos e oferecem maior risco à saúde e ao meio ambiente, a extração com DES é uma alternativa ambientalmente amigável e conexa com os princípios da química verde.29 Nesta perspectiva, o presente trabalho propõe a aplicação de solvente eutético profundo hidrofílico, composto por ChCl:Ox para extração de Cu em amostras de chás e posterior determinação por GF AAS. Para a otimização dos experimentos, uma abordagem multivariada foi aplicada, uma vez que os modelos estatísticos e matemáticos desta otimização permitem interpretação ampla dados analíticos. Nesse contexto, o planejamento Box-Behnken, é especialmente útil por permitir a avaliação simultânea de múltiplos fatores e suas interações com um número reduzido de ensaios, contribuindo para o desenvolvimento de métodos mais eficientes e robustos.30-32 O método otimizado foi aplicado para determinação da concentração total de Cu em diferentes amostras de chá. Adicionalmente, a concentração de Cu nas infusões também foi avaliada.
PARTE EXPERIMENTAL Amostras As amostras foram adquiridas no comércio local da cidade de Florianópolis, SC. Cinco amostras de chás de diferentes marcas de lotes únicos foram selecionadas, sendo duas amostras de chás tradicionais (preto e verde) e três de chás de ervas (boldo, frutas cítricas e camomila). As amostras foram identificadas como: (A) preto; (B) boldo; (C) verde; (D) frutas cítricas; (E) camomila. A composição química, a estrutura celular distinta das amostras, e os diversos fatores que determinam a interação do analito como os seus componentes da planta,33 podem influenciar o processo de extração. Assim, a otimização da extração com DES foi realizada com uma amostra mista, obtida pela mistura de massas iguais de cada uma das amostras (sólidas) de chá analisadas. Para verificar a exatidão foram utilizados os materiais de referência com concentrações certificadas para o Cu (CRMs, certified reference materials): NCS ZC 73014 (chá) e NCS DC 73349 (folhas de arbusto). Instrumentação, reagentes e soluções As amostras foram moídas em moinho de bolas (Retsch MM200, Pensilvânia, EUA) e pesadas usando uma balança analítica modelo Mark Série M (BEL Engineering, Itália). Todas as soluções foram preparadas com água ultrapura (resistividade de 18,2 MΩ cm) obtidas a partir de um purificador Pureza Ultra (Elga LabWater, Reino Unido). Todos os reagentes utilizados foram de grau analítico. Para a síntese do DES foram utilizados cloreto de colina 99% (Merck, Alemanha) e ácido oxálico 99% (Merck, Alemanha), submetidos ao aquecimento em banho de água utilizando chapa, modelo TE-0854 (Tecnal, Brasil). Os reagentes utilizados para a síntese do DES foram previamente secos em estufa (Biomatic, Brasil) a 90 ± 5 ºC, durante 4 h. A caracterização do DES foi realizada por meio da espectroscopia de infravermelho com transformada de Fourier (FTIR, Fourier transform infrared spectroscopy, Bruker Alpha, EUA). Para determinação da concentração total de Cu usando extração com DES, as amostras foram pesadas em tubos de polipropileno de 15 mL. Para homogeneização e extração foram utilizados, respectivamente, vórtex modelo CRV-45X (CAPP, Dinamarca) e banho ultrassônico modelo T50 (Thornton, Brasil), operando a 40 kHz e 200 W. Posteriormente, os extratos foram centrifugados em uma centrífuga microprocessada modelo Q222TM216 (Quimis, Brasil) e acidificados com HNO3 2% (v v-1). Água ultrapura foi utilizada no preparo de soluções de calibração e diluição dos extratos das amostras. Para a quantificação da concentração total (após extração com DES) e a fração solúvel de Cu (extraída na infusão) nas amostras de chá, as medições foram realizadas em espectrômetro de absorção atômica AAnalyst 100 (PerkinElmer, EUA) com fonte de linha e atomização em forno de grafite com plataforma e recobrimento pirolítico. Uma lâmpada de cátodo oco de Cu operando a 8 mA foi utilizada, monitorando o comprimento de onda em 324,83 nm. Preparo e caracterização do DES O DES foi preparado conforme descrito por Habibi et al.28 Este solvente é aplicado com sucesso para extração de metais em amostras vegetais, biológicas e alimentícias.26,34,35 Em resumo, o DES foi obtido pela mistura entre cloreto de colina (ChCl, HBA) e ácido oxálico (Ox, HBD), na razão molar de 1:1. As massas previamente estabelecidas foram pesadas diretamente em tubos de polipropileno. Os tubos contendo os reagentes foram submetidos ao aquecimento em banho-maria a 90 ± 5 ºC e agitação eventual em vórtex até a obtenção de um líquido incolor e homogêneo. A caracterização dos respectivos precursores e do DES é amplamente descrita na literatura,36,37 entretanto, para confirmação da formação do DES, a análise por FTIR foi empregada, cujas amostras sólidas foram analisadas como pastilhas a partir da mistura entre 1% da amostra e KBr, homogeneizadas e prensadas a 80 N m-2. Otimização do processo de extração Para determinação da concentração total de Cu nas amostras de chá, a otimização das condições para extração do Cu com DES foi realizada por meio de um planejamento experimental Box-Behnken com três repetições do ponto central, usando o software Statistica, versão 6.0.38 As variáveis avaliadas foram tempo, temperatura e porcentagem de água no DES (m m-1). As variáveis e os seus respectivos níveis são apresentados na Tabela 1.

A concentração total de Cu foi diretamente determinada nas amostras sólidas, a extração foi realizada utilizando 50 mg de amostra e 1 g de DES com 20% (m m-1) de água (DES 20%, m m-1). As amostras e o DES foram pesados diretamente em tubos de polipropileno de 15 mL, homogeneizados com o auxílio de vórtex e submetidos à extração em banho ultrassônico (45 min) a temperatura de 60 ºC. Ao término do processo, as amostras foram avolumadas com água ultrapura para 10 mL, homogeneizadas e centrifugadas durante 10 min a 3500 rpm. O sobrenadante foi extraído, acidificado com HNO3 a 2% (v v-1) e diluído para posterior determinação da concentração de Cu por GF AAS. O fator de diluição das amostras B, C e D foi de 2 vezes, enquanto da amostra A foi 2,5 vezes e, a amostra E não necessitou de diluição prévia. Adicionalmente, o procedimento de preparo de amostra para o método proposto utilizando extração com DES foi avaliado do ponto de vista da GAC. Esta avaliação foi realizada por meio da ferramenta métrica AGREEprep.39,40 Parâmetros instrumentais Para as medições por GF AAS, uma alíquota de 20 μL dos extratos obtidos da amostra e/ou solução padrão em meio aquoso foi injetada no atomizador com auxílio de um amostrador automático. Considerando a estabilidade térmica e o perfil adequado do sinal para Cu, as medições foram realizadas sem uso de modificador químico. O programa de temperaturas otimizado para a determinação de Cu por GF AAS é apresentado na Tabela 2.
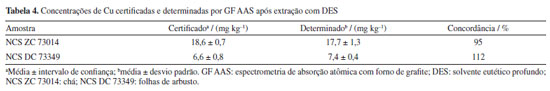
Curvas de calibração Diferentes técnicas de calibração foram avaliadas: (i) calibração externa, realizada com soluções padrão em meio aquoso acidificadas com HNO3 a 2% (v v-1); (ii) calibração por simulação da matriz, na qual os padrões de calibração foram preparados com DES, na mesma concentração dos extratos diluídos das amostras. Neste caso, sobre alíquotas de 2,5 mL de solução contendo 10% (m v-1) do DES 20% (m m-1), adicionou-se as respectivas alíquotas da solução estoque de Cu para obtenção da determinada concentração da solução padrão e 100 μL de HNO3. Posteriormente, as soluções foram avolumadas com água ultrapura para 5 mL; (iii) calibração por adição de analito, na qual a cada um dos padrões de calibração foi adicionado uma alíquota do extrato da amostra com DES. Neste caso, sobre alíquotas de 2,5 mL de extrato da amostra com DES, foram adicionadas as respectivas alíquotas da solução estoque de Cu para obtenção das determinadas soluções padrão de calibração e 100 μL de HNO3. Posteriormente, o volume das soluções foi completado com água até 5 mL. Considerando o DES (20% m m-1) e as respectivas alíquotas utilizadas nos padrões de calibração por simulação de matriz e adição do analito, a concentração final do DES nestas soluções foi de 4% (m v-1). Para todas as técnicas de calibração avaliadas, a faixa de calibração empregada para a determinação de Cu por GF AAS foi entre 5 e 80 μg L-1. Figuras de mérito As figuras de mérito determinadas para o método proposto foram: LOD, LOQ (limite de quantificação), massa característica, coeficiente de determinação (R2) e desvio padrão relativo (RSD). A precisão foi avaliada por meio do cálculo do RSD, obtido a partir de três replicatas (n = 3). Os valores de LOD e LOQ foram calculados conforme o método descrito por Miller e Miller,41 considerando, respectivamente, a razão de três e dez vezes o desvio padrão de dez medições consecutivas da solução do branco, dividido pelo coeficiente angular obtido na curva de calibração.38,41,42 A exatidão do método proposto foi avaliada por meio da análise dos seguintes materiais de referência certificados (CRMs): NCS ZC 73014 (chá) com concentração certificada de Cu igual a 18,6 ± 0,7 mg kg-1 e NCS DC 73349 (folhas de arbusto) contendo 6,6 ± 0,8 mg kg-1 de Cu. Concentração de Cu na infusão Neste trabalho, a concentração de Cu presente nas infusões das amostras foi denominada fração solúvel, a qual refere-se à fração de Cu extraída durante o preparo da bebida. Considerando o volume final de 50 mL de bebida preparada, as massas de chá utilizadas para a obtenção das infusões foram ajustadas de acordo com as instruções de preparo da bebida especificadas nos rótulos de cada produto, de modo a refletir fielmente as condições de consumo recomendadas pelo fabricante. Desta forma, as massas pesadas para cada uma das amostras analisadas foram: A 0,35 g; B 0,20 g; C 0,35 g; D 0,55 g; E 0,28 g. As infusões foram preparadas em triplicata, utilizando água a 90 ± 5 ºC e tempo de infusão de 5 min. Posteriormente, as amostras foram filtradas e a concentração dos analitos no sobrenadante foi determinada utilizando condições instrumentais otimizadas para determinação de Cu após a extração com DES. Para fins de comparação com a concentração total de Cu, considerando as respectivas massas de chá e o volume final das infusões preparadas, a fração solúvel do analito nas infusões foi expressa mg kg-1.
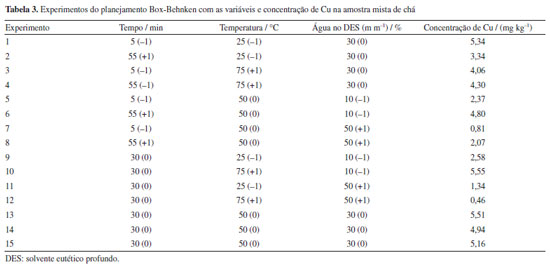
RESULTADOS E DISCUSSÃO Otimização do processo de extração Os fatores estabelecidos para a avaliação da extração (tempo, temperatura e porcentagem de água no DES, m m-1) foram otimizados por meio de um planejamento experimental Box-Behnken, conforme apresentado na Tabela 3.
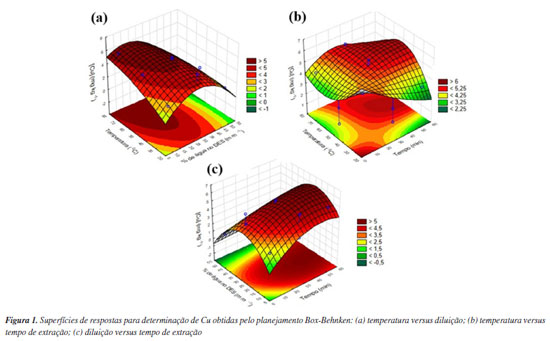
O gráfico de Pareto obtido a partir dos resultados indicou os fatores que influenciaram na extração (Figura 1S, Material Suplementar), de forma que resultados considerados estatisticamente significativos (95% de confiança) extrapolam a linha limite (p = 0,05). Observou-se que a diluição do DES foi um fator significativo, o qual está relacionado com a redução da viscosidade do solvente. Solventes menos viscosos favorecem a dispersão da amostra e sua interação com o solvente, contribuindo para a extração do analito.14,25,35,43 Além disso, o termo quadrático positivo indicou curvatura na superfície de resposta, evidenciando interações entre variáveis e sua influência favorável na extração. O gráfico de resíduos (Figura 2S, Material Suplementar), comparou os valores observados com os preditos, e proporcionou uma avaliação da normalidade dos dados. É notável que os pontos experimentais estão bem distribuídos ao longo da reta, indicando uma correspondência satisfatória entre os valores previstos pelo modelo e a distribuição normal dos resíduos em relação à concentração de Cu. Isso fortalece a confiança na capacidade do modelo em representar de forma precisa e consistente a dinâmica da extração do analito, conforme evidenciado pelos dados experimentais.30,31 Nas superfícies de resposta (Figura 1), as áreas destacadas em vermelho indicam as regiões de máxima resposta, enquanto as áreas verdes apresentam os menores valores para a variável em questão, e indicam as condições menos favoráveis para extração do analito.
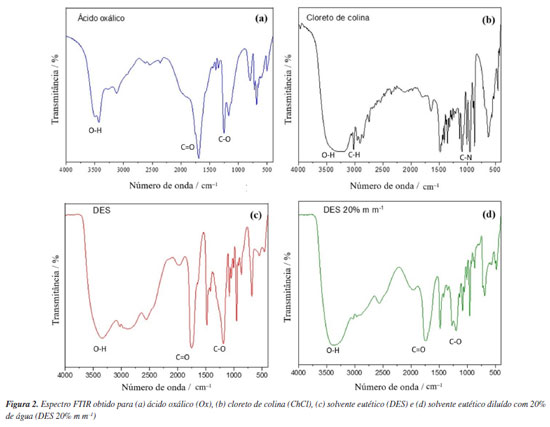
Observa-se que a interação entre as variáveis temperatura e diluição do DES (Figura 1a) sugere que uma maior eficiência de extração para Cu ocorre quando se utiliza DES com menor porcentagem de água e temperaturas de extração mais elevadas. Este fato pode ser explicado pela redução da diluição, a qual aumenta a concentração dos grupos funcionais capazes de interagir com o analito, favorecendo a extração. Entretanto, a influência mútua entre a temperatura e a viscosidade também exerce um efeito positivo na extração, pois com o aumento da temperatura, a viscosidade do solvente eutético é reduzida, tornando-o mais fluido.14,16,44,45 A avaliação da interação entre a temperatura e o tempo de extração (Figura 1b) sugeriu que temperaturas mais elevadas combinadas a tempos mais longos tendem a favorecer a extração do Cu, permitindo maximizar a transferência de analitos da matriz para o solvente. A interação entre as variáveis porcentagem de água no DES (m m-1) e tempo (Figura 1c) indicou que a extração de Cu é favorecida em tempos maiores e com menor porcentagem de água no DES. Para confirmar os resultados referentes à obtenção da condição ótima, empregou-se a função desejabilidade. Esta função, transforma cada resposta em uma escala de 0 a 1, onde 1 representa a condição ideal (desejável) e 0 indica uma resposta inaceitável. Neste caso, configurou-se o processo para atingir a extração máxima, permitindo até 100 interações, ou seja, o software realizou 100 ciclos de otimização para encontrar a combinação de condições experimentais que proporcionasse a máxima eficiência da extração.30-32 Considerando estes resultados, as condições otimizadas foram DES contendo 20% de água (m m-1), 45 min de extração em ultrassom à temperatura de 60 ºC. Caracterização do DES O DES composto por ChCl:Ox (1:1) foi preparado conforme descrito por Habibi et al.28 Embora a síntese deste solvente seja conhecida e este esteja bem caracterizado na literatura,7,28,43 o DES preparado na forma pura e diluída (20% m m-1), bem como os seus respectivos reagentes precursores foram caracterizados por FTIR (Figura 2). A formação do DES composto por ChCl:Ox (1:1) foi facilmente observada a partir da formação de um líquido viscoso e incolor à temperatura ambiente. Adicionalmente, a caracterização por FTIR foi utilizada para confirmar a formação do DES. Os DES formados pelos precursores ChCl e Ox são amplamente empregados na literatura,26,27,37 sendo utilizados para extração de metais e compostos orgânicos nas mais diversas amostras. Em geral, os DES derivados do ChCl possuem boa estabilidade em condições adequadas de armazenamento. Estes solventes apresentam também boa estabilidade térmica e, dependendo da composição, podem manter-se estáveis até temperaturas de 160 ºC.46,47 Entretanto, cabe ressaltar que, quando armazenados por longos períodos, pode haver a cristalização do solvente.47
Conforme apresentado na Figura 2, o espectro do Ox (Figura 2a) mostrou estiramentos de O-H em 3500 cm-1, de C-O em 1250 cm-1 e de C=O em 1700 cm-1 típicos de ácidos carboxílicos. Já o espectro para ChCl (Figura 2b), apresentou estiramentos de O-H associado às ligações de OH-Cl em 3250 cm-1.36 Na região próxima a 3000 cm-1 há um estiramento C-H e sinais na região próxima de 1000 cm-1, associado às vibrações da ligação C-N.48 Ainda, segundo Saha et al.36 o sinal em 1477 cm-1 pode ser associado às vibrações típicas das ligações C-N no ChCl. No DES (Figura 2c) os sinais observados nas regiões próximas as frequências de 1700 e 1250 cm-1, respectivamente, estão associados aos estiramentos C=O e C-O, confirmando a presença de Ox no solvente.36 Neste espectro é possível observar deformações angulares na região de 1477 cm-1, indicando a formação de ligações de hidrogênio entre Ox e ChCl, confirmando a obtenção do solvente.49,50 Para o DES diluído (contendo 20% m m-1 de água) (Figura 2d), é possível observar no espectro deformações semelhantes de C-N.49,50 No entanto, observou-se uma banda mais larga e intensa de estiramento O-H em 3400 cm-1, possivelmente devido às ligações de hidrogênio relacionadas à adição de água no DES. Curvas de pirólise e atomização O Cu é um elemento termicamente estável que geralmente pode ser determinado por GF AAS sem a necessidade do uso de modificadores químicos.50,51 Entretanto, é importante que uma condição compromisso referente às temperaturas de pirólise e atomização seja estabelecida, garantindo a máxima eliminação da matriz e uma atomização eficiente sem que haja perda do analito.52,53 Para avaliar o comportamento térmico do Cu em meio aquoso (solução padrão 30 µg L-1) e no extrato da amostra após a extração com DES (20% m m-1), as curvas de pirólise e atomização foram avaliadas (Figura 3).
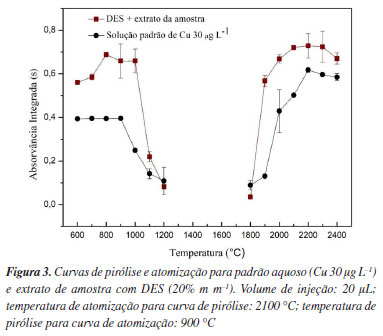
A curva de pirólise foi obtida variando a temperatura de pirólise de 600 a 1200 ºC e mantendo a temperatura de atomização fixa em 2100 ºC. Conforme esperado, o Cu apresentou uma boa estabilidade térmica em meio aquoso e no extrato da amostra após extração com DES, possibilitando a utilização de temperaturas de pirólise de 900 e 1000 ºC para padrão aquoso e extrato da amostra, respectivamente. A maior estabilização térmica do Cu no extrato da amostra após a extração com DES pode ser resultado da presença dos concomitantes da matriz da amostra extraídos para o meio, pois sabe-se que, dependendo da composição, a matriz da amostra pode proporcionar um aumento na estabilidade térmica do analito.54,55 Entretanto, a temperatura de pirólise de 900 ºC foi selecionada para realização dos experimentos, pois temperaturas mais elevadas promovem uma redução na intensidade do sinal do Cu para o padrão aquoso. Caldas et al.56 empregaram uma temperatura de pirólise de 1000 ºC para determinar Cu em óleo mineral isolante por GF AAS, sendo esta temperatura próxima a utilizada neste trabalho. As curvas de atomização foram obtidas variando a temperatura de atomização entre 1800 e 2400 ºC, mantendo fixa a temperatura de pirólise em 900 ºC. Em relação às curvas de atomização, observou-se que inicialmente houve um aumento na intensidade do sinal e a subsequente estabilização, indicando que a temperatura de atomização alcançou um ponto ótimo para a produção eficiente de átomos livres do analito no estado gasoso. A análise dos perfis dos sinais indicou que a temperatura de atomização de 2100 ºC proporcionou sinais com perfis mais definidos quando comparados aos sinais obtidos em 2200 ºC. Desta forma, a temperatura de 2100 ºC foi selecionada como temperatura ótima para etapa de atomização. Esta mesma temperatura de atomização foi utilizada por Rocha,57 na determinação de Cu em amostras de néctares e sucos industrializados. Nota-se, entretanto, que a precisão das medições nos extratos das amostras foi ligeiramente inferior à observada nas soluções padrão. Esse comportamento pode estar relacionado com a complexidade da matriz das amostras, a qual pode influenciar a reprodutibilidade dos sinais. As curvas de pirólise e atomização para o Cu, tanto no extrato quanto na solução aquosa, exibiram perfis similares, entretanto, observou-se uma diferença na intensidade de sinal do analito entre as soluções, que se deve às distintas concentrações do analito nos respectivos meios. Neste contexto, considerando as curvas de pirólise e atomização, bem como os respectivos sinais transientes obtidos para cada uma das temperaturas avaliadas, a temperatura de pirólise de 900 ºC e atomização de 2100 ºC mostraram ser adequadas para determinação de Cu em amostras de chá após extração com DES. Calibração Três técnicas de calibração foram avaliadas (calibração externa, calibração por simulação da matriz e adição de analito), em cinco níveis de concentração na faixa de trabalho entre 5-80 µg L-1. Todas as técnicas de calibração avaliadas apresentaram boa linearidade, com R2 iguais a 0,9932, 0,9930 e 0,9901, para as curvas de calibração externa, calibração por simulação da matriz e adição de analito, respectivamente, indicando uma boa correlação entre os valores de concentração e os respectivos valores de absorvâncias integradas. As sensibilidades obtidas foram 0,0178, 0,0179 e 0,0176 s L μg-1, respectivamente, para a calibração externa com padrões aquosos, simulação de matriz e adição do analito. Observou-se que as sensibilidades para as técnicas de calibração avaliadas foram similares e apresentaram valores com uma diferença inferior a 2%. Para comparar estatisticamente as sensibilidades das curvas, aplicou-se a análise de variância, ANOVA (one-way), com intervalo de confiança de 95%, e os resultados confirmaram não haver diferença significativa entre a sensibilidade das curvas de calibração avaliadas (p < 0,05). Tais dados evidenciaram a possibilidade da utilização de qualquer uma das curvas para quantificação do analito por GF AAS, entretanto, diante da maior simplicidade, a técnica de calibração externa empregando padrões em meio aquoso foi adotada para a determinação da concentração de Cu. A fim de identificar possíveis outliers de Grubbs (95% de confiança), os valores das absorvâncias para os respectivos padrões de calibração em meio aquoso foram avaliados, e valores divergentes não foram observados, propiciando a utilização de todo conjunto de dados para a curva de calibração. Figuras de mérito e verificação da exatidão O coeficiente de determinação obtido para calibração externa com padrões aquosos indicou uma boa correlação entre a concentração do analito nos padrões de calibração e os respectivos valores de absorvâncias. A massa característica de 6,4 pg e os valores de LOD e LOQ obtidos para o método proposto foram 0,2 e 0,8 mg kg-1, respectivamente. Estes valores são levemente superiores aos reportados por Ghisi et al.58 para determinação de Cu em biodiesel por GF AAS após tratamento com hidróxido de tetrametilamônio (TMAH). Possivelmente, esta variação se deve à diferença na massa de amostra utilizada pelos autores, a qual foi 10 vezes superior à massa utilizada no procedimento proposto usando extração com DES (50 mg). A precisão do método proposto foi avaliada por meio do RSD, considerando as três replicatas verdadeiras para cada uma das amostras analisadas. De modo geral, os valores de RSD (n = 3) obtidos foram inferiores a 10%, sendo estes considerados satisfatórios para o método proposto.59 A exatidão do método foi verificada por meio da análise de duas amostras de referência com concentrações certificadas para Cu (Tabela 4). Conforme observado, na condição otimizada e considerando os valores de concentração certificados, a porcentagem de concordância obtida foi de 95 e 112%, para as amostras de chá e de folhas de arbusto, respectivamente.
A comparação dos resultados determinados com as concentrações expressas nos certificados foi avaliada por meio do teste t de Student, considerando 95% de confiança e grau de liberdade igual a 2 (n = 3). Os valores de tcalculados (0,39 e 1,1) foram menores que o tcrítico (4,30), comprovando a inexistência de diferença significativa entre a concentração determinada pelo método proposto e a expressa nos valores certificados, evidenciando a exatidão adequada do método. A fim de verificar a sustentabilidade do método, o procedimento de preparo de amostras proposto foi avaliado com base nos princípios da GAC, por meio da ferramenta métrica AGREEprep. O gráfico gerado contendo a pontuação de cada princípio e os respectivos pesos está apresentado na Figura 3S (Material Suplementar). Considerando que a pontuação máxima estabelecida pela ferramenta métrica é de 1,0 ponto, pode-se afirmar que o procedimento de preparo de amostra utilizado no método proposto (pontuação de 0,64) é ambientalmente amigável. Desta forma, pode-se observar que a extração de Cu utilizando DES está de acordo com os princípios da GAC que consideram, principalmente, o uso mínimo de reagentes, baixa produção de resíduos, uso de fontes renováveis que possuam baixa ou nenhuma toxicidade e segurança ao analista, demonstrando ser uma excelente alternativa aos métodos convencionais, que utilizam grandes volumes de ácidos em elevadas concentrações.60 Determinação de Cu em amostras de chá O método proposto utilizando extração com DES foi aplicado para determinação da concentração total de Cu em diferentes amostras de chá. Os resultados das concentrações de Cu total e a respectiva fração solúvel nas infusões das amostras estão apresentados na Figura 4.
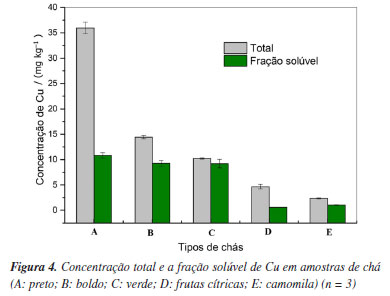
A concentração total de Cu nas amostras analisadas variou entre 2,5 a 35 mg kg-1, sendo esses valores encontrados nas amostras de chá E e A, respectivamente. Estes valores estão de acordo com o reportado na literatura,61 que indica que a concentração média desse metal em plantas é de 20 mg kg-1. A variação nas concentrações de Cu para as diferentes amostras de chá pode estar relacionada ao fato de que a mobilidade do Cu depende, dentre outros fatores, da espécie da planta. De modo geral, o deslocamento do Cu das raízes até as folhas é lento, resultado da forte interação dos seus compostos com as paredes celulares das espécies vegetais.61 Marguí et al.62 analisaram seis amostras de chás fitoterápicos utilizando o preparo de amostras sob a forma de suspensões e determinação por FAAS e ICP OES. Segundo os autores, as concentrações de Cu determinadas nas amostras analisadas variaram entre 2,1 e 16,6 mg kg-1, sendo próximos aos valores encontrados neste trabalho. Os autores ainda destacaram que a maioria das amostras avaliadas apresentaram concentrações significativas de outros elementos essenciais (Mn, Fe e Zn), e que suas concentrações também variaram em função do tipo de chá. De acordo com Manica et al.63 a concentração de Cu avaliada por FAAS após procedimento de extração sequencial em amostras de chá de Camellia sinensis variou entre 13,65 e 28,73 mg kg-1. No âmbito geral, os autores reportaram que as concentrações de Cu no tecido das plantas foram de aproximadamente 20 mg kg-1, estando de acordo com os valores encontrados neste trabalho. Os autores ainda destacaram que na legislação brasileira não há limite máximo estabelecido para concentração de Cu em chás.1,63 Jin et al.64 determinaram Cu em 20 amostras de chá, após a digestão ácida e análise por GF AAS, e as concentrações obtidas variaram entre 8,05 e 33,50 mg kg-1. Com relação aos tipos de chás, a concentração total de Cu na amostra de chá-preto (A) foi levemente superior às demais, alcançando 35,9 mg kg-1. Quanto ao chá-verde, a concentração obtida foi semelhante à determinada por Podwika et al.65 que obteve a concentração de 11,28 mg kg-1. Como supracitado, a variação nas concentrações de Cu em amostras de chá pode estar relacionada ao tipo de chá. Ainda, fatores como a região de cultivo, quantidade de matéria orgânica presente e práticas agrícolas adotadas podem exercer influência sobre a concentração de elementos essenciais e potencialmente tóxicos nas plantas.1,2,15,64 Com relação às frações solúveis de Cu nas infusões de chá, os resultados obtidos apresentaram valores entre 23,4 e 80,5 µg L-1. Esses valores são comparáveis aos observados em estudos reportados na literatura. Nagara et al.66 determinaram a concentração de Cu em infusões de diferentes amostras de chá, e os resultados obtidos variaram entre 12,1 e 395,4 µg L-1. O estudo conduzido por Podwika et al.65 indicou que a concentração média de Cu em infusões de diferentes amostras de chá analisadas foi de 50 µg L-1. Estas concentrações de Cu em infusões de chá são evidentemente inferiores ao limite máximo estabelecido para Cu (2 mg L-1) em águas destinadas ao consumo humano no Brasil.13 Considerando que as concentrações de Cu nas infusões das amostras analisadas foram entre 25 e 86 vezes inferiores ao limite máximo estabelecido para Cu em água, o seu consumo não apresenta risco à saúde. As concentrações de Cu determinadas nas infusões das amostras de chá analisadas, quando corrigidas em função da massa utilizada para preparar a infusão e volume de bebida preparado, indicam que a fração solúvel de Cu está entre 12 e 90% da concentração total do elemento nas amostras. Embora fatores como granulometria, homogeneidade da amostra, temperatura e tempo de infusão possam interferir na fração de Cu extraída, as frações solúveis determinadas no presente trabalho foram concordantes com as reportadas na literatura.8,67 Magalhães et al.68 também avaliaram a fração disponível de Cu em relação à concentração total do elemento nas amostras de chá, obtendo porcentagens de Cu entre 10 e 32%. Já no trabalho de Schulzki et al.69 os autores registraram frações disponíveis de Cu entre 21 e 79% para diferentes amostras de chá.
CONCLUSÕES A utilização do DES associada a extração assistida por ultrassom possibilitou o desenvolvimento de um método simples, rápido e eficiente para determinação da concentração total de Cu em amostras de chás por GF AAS. A otimização multivariada utilizando planejamento Box-Behnken, possibilitou determinar as condições ótimas de extração em processo assistido por ultrassom, utilizando DES (20% m m-1) como solvente extrator. A partir de uma avaliação das técnicas de calibração, observou-se que não houve diferença significativa entre as sensibilidades das calibrações externa, simulação de matriz e adição de analito, permitindo que a técnica de calibração mais simples (calibração externa com padrões aquosos) fosse utilizada para quantificação do analito. As figuras de mérito determinadas mostraram-se similares aos valores reportados na literatura, conferindo ao método boa sensibilidade e eficiência de extração. As concentrações totais de Cu determinadas nas amostras de chás analisadas resultaram entre 2,5 e 35 mg kg-1, sendo que a concentração de Cu solúvel nas respectivas infusões das amostras variou entre 12,44 e 90,12%. Não há limite estabelecido para concentração de Cu em chás, porém, as concentrações determinadas nas amostras analisadas não oferecem riscos à saúde por estarem abaixo do limite máximo estabelecido para Cu (2 mg L-1) em águas destinadas ao consumo humano no Brasil.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho (Figura 1S que apresenta o gráfico de Pareto das variáveis avaliadas no planejamento Box-Behnken para otimização da extração de Cu em amostras de chá; Figura 2S que mostra a correlação entre valores preditos e observados para o delineamento experimental Box-Behnken e a Figura 3S que apresenta os dados da avaliação da sustentabilidade utilizando a calculadora AGREEprep para o método de extração proposto) está disponível em http://quimicanova.sbq.org.br, como arquivo PDF, com acesso livre.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados estão disponíveis no texto.
AGRADECIMENTOS Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo apoio financeiro. E. S. M. (88887949213/2024-00) e C. G. (88887.950988/2024-00) são bolsistas da CAPES, F. L. G. (141509/2023-6) é bolsista do CNPq e E. S. C. (309258/20227) possui bolsa de pesquisa do CNPq.
REFERÊNCIAS 1. Kartoğlu, B.; Bodur, S.; Zeydanlı, D.; Göver, T.; Özaydın, E.; Bakırdere, E. G.; Bakırdere, E. G.; Bakırdere, S.; Food Chem. 2024, 439, 138140. [Crossref] 2. Shabbir, Z.; Sardar, A.; Shabbir, A.; Abbas, G.; Shamshad, S.; Khalid, S.; Natasha; Murtaza, G.; Dumat, C.; Shahid, M.; Chemosphere 2020, 259, 127436. [Crossref] 3. Boroughani, M.; Tahmasbi, Z.; Heidari, M. M.; Johari, M.; Hashempur, M. H.; Heydari, M.; Heliyon 2024, 10, e28829. [Crossref] 4. Kochman, J.; Jakubczyk, K.; Antoniewicz, J.; Mruk, H.; Janda, K.; Molecules 2020, 26, 85. [Crossref] 5. Tanaka, T.; Kouno, I.; Food Sci. Technol. Res. 2003, 9, 128. [Crossref] 6. Zhao, H.; Baker, G. A.; J. Chem. Technol. Biotechnol. 2013, 88, 3. [Crossref] 7. Ahmadi-Jouibari, T.; Noori, N.; Fattahi, N.; Toxin Rev. 2021, 40, 1084. [Crossref] 8. Abd El-Aty, A. M.; Choi, J. H.; Rahman, M. M.; Kim, S. W.; Tosun, A.; Shim, J. H.; Food Addit. Contam.,: Part A 2014, 31, 1794. [Crossref] 9. Gaetke, L. M.; Chow, C. K.; Toxicology 2003, 189, 147. [Crossref] 10. Araya, M.; Olivares, M.; Pizarro, F.; Llanos, A.; Figueroa, G.; Uauy, R.; Environ. Health Perspect. 2004, 112, 1068. [Crossref] 11. US Environmental Protection Agency (US EPA), Drinking Water Regulations, https://www.epa.gov/dwreginfo/drinking-water-regulations, acessado em junho 2025. 12. Gaetke, L. M.; Chow-Johnson, H. S.; Chow, C. K.; Arch. Toxicol. 2014, 88, 1929. [Crossref] 13. Ministério da Saúde; Portaria GM/MS No. 888, de 4 de maio de 2021, Altera o Anexo XX da Portaria de Consolidação GM/MS No. 5, de 28 de setembro de 2017, para Dispor sobre os Procedimentos de Controle e de Vigilância da Qualidade da Água para Consumo Humano e seu Padrão de Potabilidade; Diário Oficial da União (DOU), Brasília, No. 85, de 07/05/2021, p. 127. [Link] acessado em junho 2025 14. Zhao, T.; Li, C.; Wang, S.; Song, X.; Molecules 2022, 27, 3909. [Crossref] 15. Zietz, B. P.; De Vergara, J. D.; Dunkelberg, H.; Environ. Res. 2003, 92, 129. [Crossref] 16. Aydin, F.; Yilmaz, E.; Soylak, M.; Food Chem. 2018, 243, 442. [Crossref] 17. Zeiner, M.; Cindrić, I. J.; Kandler, W.; Stingeder, G.; Microchem. J. 2018, 136, 101. [Crossref] 18. Karasakal, A.; Food Analytical Methods 2021, 14, 344. [Crossref] 19. Lee, J.; Park, Y. S.; Lee, H. J.; Koo, Y. E.; Food Chem. 2022, 373, 131483. [Crossref] 20. Barela, P. S.; Silva, N. A.; Pereira, J. S. F.; Marques, J. C.; Rodrigues, L. F.; Moraes, D. P.; Fuel 2017, 204, 85. [Crossref] 21. Gonzalez, M. H.; da Silva, C. S.; Amaral, C. D. B.; Bianchi, S. R.; de Oliveira, L. H. B.; Coelho, J. S.; Oliveira, A.; Nogueira, A. R. A.; J. Braz. Chem. Soc. 2017, 28, 98. [Crossref] 22. Pereira, L. S. F.; Pedrotti, M. F.; Vecchia, P. D.; Pereira, J. S. F.; Flores, E. M. M.; Anal. Chim. Acta 2018, 1010, 29. [Crossref] 23. Abbott, A. P.; Capper, G.; Davies, D. L.; Rasheed, R. K.; Tambyrajah, V.; Chem. Commun. 2003, 1, 70. [Crossref] 24. Abbott, A. P.; Boothby, D.; Capper, G.; Davies, D. L.; Rasheed, R. K.; J. Am. Chem. Soc. 2004, 126, 9142. [Crossref] 25. Costa, F. S.; Moreira, L. S.; Silva, A. M.; Silva, R. J.; dos Santos, M. P.; da Silva, E. G. P.; Grassi, M. T.; Gonzalez, M. H.; Amaral, C. D. B.; J. Food Compos. Anal. 2022, 109, 104510. [Crossref] 26. Germer, F. L.; Lacerda, E. H. C.; Macedo, E. S.; Chaves, E. S.; ChemistrySelect 2024, 9, e202303825. [Crossref] 27. Gonçalves, C.; Ferreira, B. L.; Lacerda, E. H. C.; Chaves, E. S.; Chem. Pap. 2024, 78, 5433. [Crossref] 28. Habibi, E.; Ghanemi, K.; Fallah-Mehrjardi, M.; Dadolahi-Sohrab, A.; Anal. Chim. Acta 2013, 762, 61. [Crossref] 29. Santana-Mayor, A.; Rodríguez-Ramos, R.; Herrera-Herrera, A. V.; Socas-Rodríguez, B.; Rodríguez-Delgado, M. A.; TrAC, Trends Anal. Chem. 2021, 134, 116108. [Crossref] 30. Ferreira, B. L.; Kabbas Junior, T.; Block, J. M.; Granato, D.; Nunes, I. L.; Biocatal. Agric. Biotechnol. 2021, 38, 102196. [Crossref] 31. Pinheiro, D. R.; Neves, R. F.; Paz, S. P. A.; Microporous Mesoporous Mater. 2021, 323, 111250. [Crossref] 32. Abdulhameed, A. S.; Jawad, A. H.; Kashi, E.; Radzun, K. A.; ALOthman, Z. A.; Wilson, L. D.; Algal Res. 2022, 67, 102864. [Crossref] 33. Asiminicesei, D. M.; Fertu, D. I.; Gavrilescu, M.; Plants 2024, 13, 60913. [Crossref] 34. Bağda, E.; Altundağ, H.; Soylak, M.; Biol. Trace Elem. Res. 2017, 179, 334. [Crossref] 35. Panhwar, A. H.; Tuzen, M.; Kazi, T. G.; J. AOAC Int. 2018, 101, 1183. [Crossref] 36. Saha, S. K.; Dey, S.; Chakraborty, R.; J. Mol. Liq. 2019, 287, 110956. [Crossref] 37. de Sousa, A. S. B.; Lima, R. P.; da Silva, M. C. A.; Moreira, D. N.; Pintado, M. M. E.; Silva, S. M.; Polymer 2022, 259, 125314. [Crossref] 38. Statistica, versão 6; StatSoft Inc., Tulsa, OK, USA, 2001. 39. Wojnowski, W.; Tobiszewski, M.; Pena-Pereira, F.; Psillakis, E.; TrAC, Trends Anal. Chem. 2022, 149, 116553. [Crossref] 40. AGREEprep, https://mostwiedzy.pl/pl/wojciech-wojnowski,174235-1/agreeprep, acessado em junho 2025. 41. Miller, J. N.; Miller, J. C.; Statistics and Chemometrics for Analytical Chemistry, 6th ed.; Pearson Education Limited: Harlow, 2010. 42. Lister, A. S.; Sep. Sci. Technol. 2005, 6, 191. [Crossref] 43. Ninayan, R.; Markova, U.; Nizov, E.; Melesova, M.; Novikov, A. S.; Shishov, A.; Microchem. J. 2024, 200, 110252. [Crossref] 44. Qezelje, H. H.; Rajabi, M.; Parsa, E.; Adivi, S. G.; Shahi, M.; Asghari, A.; Bazregar, M.; Hosseini-Bandegharaei, A.; Curr. Anal. Chem. 2024, 20, 418. [Crossref] 45. Sihlahla, M.; Mpupa, A.; Sojka, M.; Saeid, A.; Nomngongo, P. N.; Advances in Sample Preparation 2023, 8, 100092. [Crossref] 46. García, G.; Aparicio, S.; Ullah, R.; Atilhan, M.; Energy Fuels 2015, 29, 2616. [Crossref] 47. Rengstl, D.; Fischer, V.; Kunz, W.; Phys. Chem. Phys. Chem. 2014, 16, 22815. [Crossref] 48. Wang, Y.; Peng, B.; Zhao, J.; Wang, M.; Zhao, L.; Phytochem. Anal. 2020, 31, 375. [Crossref] 49. Macchioni, V.; Carbone, K.; Cataldo, A.; Fraschini, R.; Bellucci, S.; Sep. Purif. Technol. 2021, 264, 118039. [Crossref] 50. da Silva, E. D. N.; Baccan, N.; Cadore, S.; J. Braz. Chem. Soc. 2013, 24, 1267. [Crossref] 51. Neri, T. S.; Rocha, D. P.; Muñoz, R. A. A.; Coelho, N. M. M.; Batista, A. D.; Microchem. J. 2019, 147, 894. [Crossref] 52. Maranhão, T. D. A.; Borges, D. L. G.; da Veiga, M. A. M. S.; Curtius, A. J.; Spectrochim. Acta, Part B 2005, 60, 667. [Crossref] 53. Sperling, M.; Welz, B.; Hertzberg, J.; Rieck, C.; Marowsky, G.; Spectrochim. Acta, Part B 1996, 51, 897. [Crossref] 54. Borges, A. R.; Becker, E. M.; Dessuy, M. B.; Vale, M. G. R.; Welz, B.; Spectrochim. Acta, Part B 2014, 92, 1. [Crossref] 55. Pereira, E. R.; de Almeida, T. S.; Borges, D. L. G.; Carasek, E.; Welz, B.; Feldmann, J.; Menoyo, J. C.; Talanta 2016, 150, 142. [Crossref] 56. Caldas, L. F. S.; de Paula, C. E. R.; Brum, D. M.; Lepri, F. G.; Cassella, R. J.; Quim. Nova 2014, 37, 776. [Crossref] 57. Rocha, P. S. M.: Estudo da Extração de Compostos Fenólicos em Chá Verde (Camellia sinensis) por Espectrofotometria UV-Vis; Trabalho de Conclusão de Curso, Universidade Federal Fluminense, Niterói, Brasil, 2016. [Link] acessado em junho 2025 58. Ghisi, M.; Chaves, E. S.; Quadros, D. P. C.; Marques, E. P.; Curtius, A. J.; Marques, A. L. B.; Microchem. J. 2011, 98, 62. [Crossref] 59. Kotani, A.; Watanabe, R.; Hayashi, Y.; Machida, K.; Hakamata, H.; J. Pharm. Biomed. Anal. 2024, 237, 115777. [Crossref] 60. Nowak, P. M.; Wietecha-Posłuszny, R.; Pawliszyn, J.; TrAC, Trends Anal. Chem. 2021, 138, 116223. [Crossref] 61. Tedesco, J. M.; Gianello, C.; Bissani, C. A.; Bohnem, H.; Volkweiss, S. J.; Análise de Solos, Plantas e Outros Materiais, 2ª ed.; Universidade Federal do Rio Grande do Sul: Porto Alegre, 1995. [Link] acessado em junho 2025 62. Marguí, E.; Dalipi, R.; Sangiorgi, E.; Štefan, M. B.; Sladonja, K.; Rogga, V.; Jablan, J.; X-Ray Spectrom. 2022, 51, 204. [Crossref] 63. Manica, M. A. P.; Galina, J.; Baretta, C. R. D. M.; Contribuciones a las Ciencias Sociales 2023, 16, 3083. [Crossref] 64. Jin, C. W.; Du, S. T.; Zhang, K.; Lin, X. Y.; Food Chem. Toxicol. 2008, 46, 2054. [Crossref] 65. Podwika, W.; Kleszcz, K.; Krośniak, M.; Zagrodzki, P.; Biol. Trace Elem. Res. 2018, 183, 389. [Crossref] 66. Nagara, V.; Sarkar, D.; Luo, Q.; Biswas, J. K.; Datta, R.; Biol. Trace Elem. Res. 2022, 200, 2970. [Crossref] 67. Brody, H.; Nature 2019, 566, S1. [Crossref] 68. Magalhães, I. R. S.; Soares, A. O.; Araújo, L. M.; da Costa, P. R. C.; Roland, I. A.; Borrás, M. R. L.; Biol. Trace Elem. Res. 2009, 132, 239. [Crossref] 69. Schulzki, G.; Nüßlein, B.; Sievers, H.; Food Chem. 2017, 215, 22. [Crossref]
Editor Associado responsável pelo artigo: Eduardo M. Richter |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Química Nova
Publicações da Sociedade Brasileira de Química
Caixa Postal: 26037
05513-970 São Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access