Artigo
|
|
| Otimização de extração de compostos fenólicos das folhas de Lippia alba (Mill.) N. E. Brown por ultrassom e comparação com técnicas convencionais Optimization of extraction of phenolic compounds from Lippia alba (Mill.) N. E. Brown leaves by ultrasound and comparison with conventional techniques |
|
Raphael A. de JesusI; Julio M. A. OliveiraI; José M. da SilvaI; Wenes R. da SilvaI; Alberto Wisniewski JrI; José C. F. S. FilhoII; Arie F. BlankII; Daniel A. de SouzaIII; Elma R. S. A. WarthaIII; Paulo C. L. NogueiraI; Valéria R. S. MoraesI,* Recebido: 02/02/2025 *e-mail: valrsmoraes@uol.com.br RESUMOIn this study, the ultrasound-assisted extraction (UAE) technique was used to simultaneously optimize the yield and total phenolic content (TPC) of Lippia alba leaf extracts, evaluating the effect of ethanol concentration, extraction time and solvent-to-solid ratio with the aid of Box-Behnken design and response surface methodology. The L. alba extract obtained by UAE under the optimized condition (29% ethanol, 17.8 min and solvent-to-solid ratio of 71 mL g-1) resulted in a yield of 20.33% and TPC of 30.86 mg GAE g-1 dw. The extract obtained by UAE showed higher results of extraction yield, TPC, total flavonoid content (TFC) and antioxidant activities compared to the maceration and infusion extracts. Analysis performed by high-resolution mass spectrometry allowed the identification of several iridoids, phenolic acids, phenylpropanoids and flavonoids in the extracts of L. alba, which justified the antioxidant activities of its extracts, indicating that this species can be used as a source of economically important antioxidant compounds for the food, cosmetics and pharmaceutical industries. Palavras-chave: Lippia alba; phenylpropanoids; flavonoids; iridoids; antioxidants.INTRODUÇÃO Atualmente, sabe-se que diversas doenças crônicas não transmissíveis como diabetes, doenças cardiovasculares e câncer estão relacionadas ao estresse oxidativo causado por espécies oxidantes em excesso no organismo humano. Nesse sentido, compostos fenólicos, tais como ácidos fenólicos, fenilpropanoides e flavonoides, podem agir como antioxidantes e atuar na prevenção dessas doenças.1-7 Ao longo dos anos, diversos estudos realizados com Lippia alba, conhecida popularmente no Brasil como "erva-cidreira-de-arbusto", têm demonstrado o seu importante potencial biológico, o qual está relacionado a presença de compostos fenólicos comprovadamente bioativos em sua composição.8-13 Essa planta medicinal é usada tradicionalmente para tratar diversas enfermidades como inflamações, febre e estresse.11,12 A recuperação de compostos fenólicos de plantas medicinais depende fortemente, entre outros fatores, da técnica de extração.13-15 Nesse sentido, técnicas alternativas de extração como a extração assistida por micro-ondas (EAM) e a extração assistida por ultrassom (EAU) estão sendo cada vez mais utilizadas como uma alternativa de extração mais eficiente e ambientalmente amigável em comparação as técnicas de extração convencionais como maceração, infusão e Soxhlet. A EAU possibilita reduzir o volume de solvente usado, o tempo e/ou a temperatura durante a extração, ao mesmo tempo em que pode resultar em um aumento no rendimento dos compostos extraídos e melhoria da seletividade do processo, além de atender aos requisitos da "extração verde" devido a possibilidade da utilização de solventes menos prejudiciais ao meio ambiente como água e etanol.7,16-19 Vale ressaltar que até o momento não foram encontrados estudos na literatura sobre otimização do processo de extração de compostos fenólicos das folhas de L. alba por ultrassom, empregando metodologia de superfície de resposta. Essa ferramenta estatística possibilita avaliar o efeito das variáveis de extração sobre o processo, além de permitir a otimização das variáveis estudadas em busca das melhores respostas.20,21 Portanto, este trabalho teve como objetivos realizar a otimização de extração dos compostos químicos das folhas de L. alba por EAU, visando o maior rendimento de extração e o maior teor de fenólicos totais, avaliando o efeito da concentração de etanol, do tempo de extração e da relação solvente para sólido; comparar os resultados fitoquímicos e antioxidantes dos extratos obtidos através dessa técnica com aqueles dos extratos obtidos por técnicas convencionais (maceração e infusão) e identificar os compostos químicos, por meio da espectrometria de massas de alta resolução, que possam ser responsáveis pelas atividades antioxidantes apresentadas pelos extratos.
PARTE EXPERIMENTAL Reagentes Metanol (grau HPLC), etanol (grau analítico) e ácido fórmico (grau analítico, 85% v/v) foram comprados da Tedia (Fairfield, OH, EUA), Merck (Darmstadt, Alemanha) e Dinâmica (Indaiatuba, SP, Brasil), respectivamente. O reagente de Folin-Ciocalteu, 2,2-difenil-2-picrilhidrazil (DPPH), sal de diamônio 2,2'-azino-bis(ácido 3-etilbenzotiazolina-6-sulfônico) (ABTS) (Sigma-Aldrich, St. Louis, MO, EUA), 2,4,6-tris(2-piridil)-s-triazina (TPTZ), ácido gálico, catequina e ácido 6-hidroxi-2,5,7,8-tetrametilcroman-2carboxílico (Trolox) foram comprados da Sigma-Aldrich (St. Louis, MO, EUA). Todos os outros reagentes utilizados (tricloreto de alumínio hexa-hidratado, hidróxido de sódio, carbonato de sódio anidro, ácido clorídrico, acetato de sódio, nitrito de sódio, cloreto férrico hexa-hidratado e sulfato de ferro hepta-hidratado) foram de grau analítico ou superior. Água deionizada foi obtida a partir de um sistema Milli-Q (Millipore, São Paulo, Brasil). Material botânico Folhas da espécie L. alba (número de registro SisGen A8CCB3B) foram coletadas em abril de 2019 na Fazenda Experimental "Campus Rural da Universidade Federal de Sergipe (UFS)" onde foram cultivadas. Estas plantas pertencem ao Banco Ativo de Germoplasma de Plantas Medicinais e Aromáticas da UFS. Exsicata da espécie foi depositada no Herbário da UFS com número de registro 13466 (Departamento de Biologia, São Cristóvão, Sergipe, Brasil). Após a coleta, as folhas foram secas em estufa de circulação forçada (Modelo MA 035, Marconi, Piracicaba, SP, Brasil) a 40 ºC durante 50 h e trituradas em um processador comercial (Eletronic Pro 2 em 1, Britânia, Joinville, SC, Brasil). O material triturado foi classificado utilizando-se peneiras para análise granulométrica (Bertel, Caieiras, SP, Brasil) a um tamanho de partícula entre 35 e 60 mesh (segundo o sistema Tyler) e armazenado em frascos de vidro com tampa a temperatura ambiente. Extração por ultrassom e planejamento Box-Benhken A extração assistida por ultrassom foi realizada em um banho de ultrassom (Elma, Elmasonic P 60H, Alemanha) a uma frequência de 37 kHz (potência nominal de operação de 150 W) e temperatura de 30 ± 1 ºC. O material (0,5 g) foi colocado em um frasco de vidro cilíndrico (100 mL) com tampa e extraído de acordo com as condições de concentração de etanol em água, tempo de extração e relação solvente para sólido especificadas no planejamento BoxBenhken (PBB) utilizado com três variáveis e três níveis (Tabela 1): concentração de etanol em água (X1: 10, 30 e 50%, v/v), tempo de extração (X2: 10, 15 e 20 min) e relação solvente para sólido (X3: 40:1, 60:1 e 80:1 mL g-1).
O intervalo das variáveis independentes estudadas (Tabela 1) foram determinadas com base em um planejamento experimental de fator único (Figuras 1Sa-1Sc, Material Suplementar). Todos os experimentos foram executados em ordem aleatória e três réplicas no ponto central foram utilizadas para a estimativa do erro experimental. A temperatura e o tempo de extração foram continuamente monitorados através do painel do equipamento. Para manter a temperatura do banho constante (± 1 ºC), quando necessário, pequenos volumes de água destilada foram retirados do banho e substituídos por volumes iguais de água destilada gelada. A relação entre as variáveis dependentes e independentes do PBB pôde ser explicada por uma função polinomial do segundo grau (Equação 1). 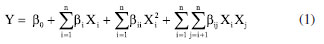 em que Y corresponde a variável resposta medida; Xi e Xj (n entre 1 e 3) correspondem às variáveis independentes avaliadas no planejamento; β0 é uma constante; βi, βii, βij são os coeficientes de regressão do modelo: βi para os termos lineares; βii para os termos quadráticos; e βij para os termos de interação. Para os cálculos utilizados na determinação das condições ótimas de extração por EAU, considerando a maximização simultânea (utilizando a função de desejabilidade) do rendimento de extração e do TF das folhas da espécie estudada, foi adotada a seguinte consideração: todas as variáveis possuem igual importância, ou seja, mesmo fator de peso e impacto.22,23 Para a validação das condições de extração otimizadas, foram realizadas extrações em triplicata, empregando as condições ótimas preditas para as duas respostas simultaneamente. Extração por maceração A extração por maceração hidroetanólica foi realizada seguindo condições semelhantes às otimizadas no processo de ultrassom. Inicialmente, 0,5 g de material triturado foi colocado em um frasco de vidro cilíndrico (100 mL) com tampa e extraído com 35,5 mL de solução etanólica em água (29%, v/v) (mesma relação solvente para sólido da EAU, 71:1 mL g-1) a uma temperatura de 30 ºC durante 17 min e 48 s. As extrações foram realizadas em triplicata. Extração por infusão A extração por infusão foi realizada seguindo a metodologia descrita por Jesus et al.23 Inicialmente, 0,4 g de material triturado foi colocado em um béquer (25 mL) e extraído com 20 mL de água ultrapura aquecida a 92 ºC, em forno de micro-ondas (relação solvente para sólido de 50:1 mL g-1), e deixado em repouso durante 10 min a temperatura ambiente (26 ± 1 ºC). As extrações foram realizadas em triplicata. Tratamento dos extratos e rendimento de extração Todos os extratos obtidos foram filtrados sob pressão reduzida através de papel filtro para a remoção do particulado. Posteriormente, os extratos aquosos foram congelados em ultrafreezer a -80 ºC (Liotop UFR30, Liobras, São Carlos, SP, Brasil) e liofilizados a -58 ºC e pressão abaixo de 100 μHg (Liotop L101, Liobras, São Carlos, SP, Brasil) por 48 h para remoção do solvente aquoso. Os extratos hidroetanólicos foram submetidos a evaporação a pressão reduzida para a remoção do solvente orgânico a 45 ºC, congelados em ultrafreezer a -80 ºC e liofilizados a -58 ºC e pressão abaixo de 100 μHg, para a remoção do solvente aquoso remanescente. Todos os extratos brutos foram armazenados em potes de vidro fechados e estocados em freezer abaixo de -10 ºC ao abrigo da luz. Os rendimentos dos extratos foram calculados de acordo com a Equação 2: 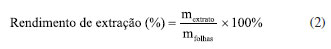 onde mextrato é a massa de extrato seco (em g) e mfolhas é a massa de folhas secas e trituradas (em g) utilizadas na extração. Teor de compostos fenólicos (TF) e teor de flavonoides (TFL) O TF dos extratos foi avaliado utilizando o reagente de Folin-Ciocalteu e TFL foi avaliado por meio da reação de complexação empregando tricloreto de alumínio hexa-hidratado (AlCl3.6H2O), ambos seguindo metodologias descritas por Jesus et al.23 O TF foi expresso como miligrama de equivalente de ácido gálico por grama de material vegetal seco (mg EAG g-1 ms), determinado a partir de uma curva de calibração (0-200 mg L-1, y = 0,0052x + 0,0739, coeficiente de determinação (R2) igual a 0,9977), e o TFL foi expresso como miligrama de equivalente de catequina por grama de material seco (mg EC g-1 ms), determinado a partir de uma curva de calibração (0-300 mg L-1, y = 0,0019x + 0,0528, R2 = 0,9975). Os experimentos foram realizados em triplicata e os resultados foram expressos como média ± desvio padrão. Ensaios antioxidantes Os ensaios de atividades antioxidantes [método de inibição do radical DPPH, método de inibição do radical ABTS e potencial redutor férrico (FRAP, do inglês, ferric-reducing antioxidant power)] foram realizados seguindo metodologias descritas por Jesus et al.23 A capacidade antioxidante de cada extrato foi expressa como micromol de equivalente de Trolox por grama de material vegetal seco (µmol ET g-1 ms) e determinada a partir de uma curva de calibração para cada metodologia (radical DPPH: 0-700 µmol L-1, y = -0,0019x + 1,7464, R2 = 0,9977; radical ABTS: 0-700 µmol L-1, y = -0,0010x + 0,7118, R2 = 0,9978; FRAP: 0-2000 µmol L-1, y = 0,0010x + 0,1550, R2 = 0,9974). Os experimentos foram realizados em triplicata e os resultados foram expressos como média ± desvio padrão. Análises por espectrometria de massas de alta resolução (FT-Orbitrap) As soluções dos extratos foram preparadas na concentração de 0,5 mg mL-1. Os extratos de EAU e maceração foram dissolvidos em solução hidroetanólica (50%, v/v), enquanto o extrato de infusão foi dissolvido em água deionizada. Os extratos solubilizados foram então centrifugados a 13.400 rpm por 5 min e os sobrenadantes foram transferidos para tubos Eppendorf. O processamento dos espectros de massas FT-Orbitrap e a atribuição das fórmulas moleculares foram realizados de acordo com Nascimento et al.14 Análises estatísticas O planejamento Box-Behnken e a análise de regressão dos dados experimentais foram realizadas usando o software Minitab 19 versão teste.24 A análise de variância (ANOVA) foi realizada para verificar a significância estatística das variáveis independentes analisadas (p < 0,05). Os parâmetros estatísticos R2, coeficiente de determinação ajustado (R2ajustado), teste de Fisher (teste F) e coeficiente de variação (C.V.) foram usados para verificar a adequação dos modelos propostos aos dados obtidos. Para a realização dos cálculos estatísticos de média e desvio padrão, foi utilizado o software Excel.25 A diferença estatística entre os resultados obtidos empregando diferentes condições e/ou técnicas de extração foi avaliada utilizando a ANOVA e teste de Tukey (p < 0,05) realizados no software PAST v. 3.0.26
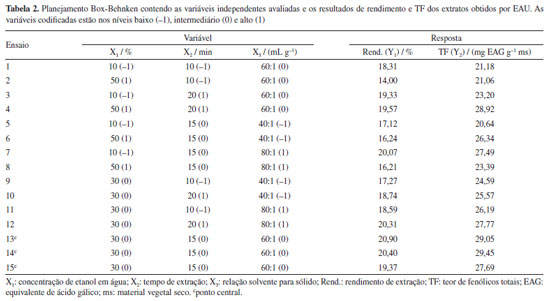
RESULTADOS E DISCUSSÕES Otimização por EAU Para determinar as condições ótimas de extração das folhas de L. alba por EAU e avaliar os efeitos das variáveis estudadas no rendimento e no TF dos extratos obtidos, foi utilizado um planejamento Box-Benhken como uma metodologia de superfície de resposta. Esse planejamento e as respostas obtidas nas diferentes condições de extração avaliadas estão mostrados na Tabela 2, na qual pode ser observado que os rendimentos de extração variaram entre 14,00 e 20,90% e os valores de TF variaram entre 20,64 e 29,45 mg EAG g-1 ms.
Pode-se observar na Tabela 2 que os valores de rendimento e TF dos extratos obtidos variam de acordo com as condições de extração, o que sugere influência de alguma variável nessas respostas. No entanto, para avaliar qual variável apresenta influência significativa nos resultados recorre-se a gráficos de Pareto (Figuras 2Sa e 2Sb, Material Suplementar), o qual apresenta os termos significativos (p < 0,05) referentes às variáveis estudadas e efeito relativo (positivo ou negativo) de cada uma no valor do rendimento ou TF dos extratos. Através do gráfico de Pareto (Figura 2Sa, Material Suplementar), pode-se observar que os termos referentes às variáveis concentração de etanol (X1), tempo de extração (X2) e relação solvente para sólido (X3) apresentaram efeitos significativos no rendimento de extração: X1 possui efeito negativo, X2 e X3 possuem efeito positivo. O termo quadrático (X1X1) apresentou efeito negativo. O termo de interação X1X2 também foi significativo, apresentando efeito positivo. Adicionalmente, o termo referente ao tempo de extração (X2) exerce influência significativa no TF, sendo seu efeito positivo (Figura 2Sb, Material Suplementar). O termo quadrático da concentração de etanol (X1X1) e o termo de interação X1X3 apresentaram-se significativos, ambos com efeitos negativos em relação ao TF. Os demais termos, considerando a respectiva resposta, não foram significativos. Um efeito linear positivo (como aqueles apresentados por X2 e X3) indica que a resposta sofre um aumento com a variação dessa variável do nível baixo para o alto. Um efeito quadrático negativo (como observado para X1X1) indica um ponto de máximo de recuperação dos compostos extraídos com a modificação dessa variável.7,14,19 Esses resultados mostram que essas variáveis, nos níveis testados, apresentam influência na extração por ultrassom de compostos fenólicos das folhas de L. alba. Os efeitos das variáveis independentes no rendimento e no TF dos extratos podem ser observados por meio de gráficos de superfície de resposta tridimensional (Figura 3S, Material Suplementar). Na Figura 3S (Material Suplementar) observa-se um aumento inicial do TF com o acréscimo da concentração de etanol até aproximadamente 30%, seguido por uma redução a partir desse ponto. Esse padrão pode ser atribuído, principalmente, à semelhança de polaridade entre os compostos fenólicos extraídos e o solvente de extração nessa concentração específica de etanol. É amplamente reconhecido que a eficiência da extração está diretamente relacionada à compatibilidade de polaridade entre o solvente e os compostos-alvo, o que influencia diretamente sua solubilidade e, portanto, no processo de transferência de massa dos compostos da matriz para o solvente de extração. No entanto, concentrações elevadas de etanol podem promover a desnaturação de proteínas e dificultar a solubilização de compostos fenólicos presentes na matriz vegetal, afetando negativamente a transferência de massa no processo. Esses fatores ajudam a explicar a redução observada no TF em concentrações superiores a aproximadamente 30% de etanol.9,23 Com base na análise de regressão, a relação entre as variáveis independentes no rendimento e no TF, separadamente, podem ser descritas por meio de equações polinomiais quadráticas (Equação 3 para o rendimento e Equação 4 para o TF). 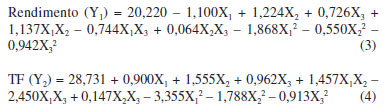 em que X1, X2 e X3, nas Equações 3 e 4, são as variáveis codificadas concentração de etanol, tempo de extração e relação solvente para sólido, respectivamente. Os modelos individuais propostos para descrever o rendimento e TF dos extratos foram considerados significativos, apresentando F-valor (p-valor < 0,05) calculados acima daquele considerado expressivo para cada modelo (Tabela 1S, Material Suplementar). Os modelos apresentaram bons ajustes às respostas como evidenciado pelos altos valores de R2 de 0,9473 e 0,9185, respectivamente para o rendimento e TF. Adicionalmente, os altos valores dos coeficientes de determinação ajustados (R2ajustado) de 0,8524 e 0,7717, para o rendimento e TF respectivamente, ambos próximos aos respectivos R2, confirmam a grande significância do modelo obtido e o alto grau de correlação entre os valores experimentais e os preditos. Esses resultados indicam uma alta capacidade dos modelos em prever a relação entre as variáveis independentes e dependentes (respostas). Além disso, os valores dos coeficientes de variação (C.V.) menores que 10% (4,01% para o rendimento e 5,66% para o TF) indicam que há uma grande precisão e confiabilidade dos dados experimentais e uma baixa variação das respostas em relação ao valor médio dos experimentos, considerando as respectivas respostas.7,19,27,28 Assim, os modelos estimados podem ser adequadamente utilizados para prever o rendimento e o TF dos extratos obtidos da espécie L. alba. Através dos experimentos realizados foi possível observar que as três variáveis estudadas influenciaram o rendimento e o TF dos extratos de L. alba, com destaque para o efeito da concentração de etanol no rendimento e para a concentração de etanol e o tempo de extração no TF. Com base nos resultados estatísticos, o rendimento de extração predito pelo modelo (Equação 3) utilizando as condições otimizadas de extração por EAU (28,59% de etanol, 20 min e 69,09 mL g-1) foi de 21,07%. Segundo o modelo proposto para a resposta TF (Equação 4), as condições ótimas de extração foram: 31,01% de etanol, 17,37 min e 69,90:1 mL g-1, obtendo um valor ótimo de TF predito pelo modelo de 29,36 mg EAG g-1 ms. Otimização de resposta múltiplas por EAU As condições de extração ótimas preditas para cada resposta separadamente (rendimento: 28,59% de etanol, 20 min e 69,09 mL g-1; TF: 31,01% de etanol, 17,37 min e 69,90:1 mL g-1) foram diferentes daquelas preditas para a maximização das duas respostas simultaneamente por EAU: 29% de etanol, 17,8 min e relação solvente para sólido de 71:1 mL g-1. Dessa forma, para a validação das condições ótimas de extração para as duas respostas avaliadas, foram realizadas três extrações utilizando as condições otimizadas de forma simultânea (desejabilidade de 0,9923): 29% de etanol, 17,8 min e relação solvente para sólido de 71:1 mL g-1. A Tabela 3 mostra os valores experimentais e preditos de rendimento de extração e TF dos extratos de L. alba obtidos por EAU nessas condições.
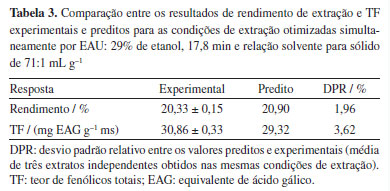
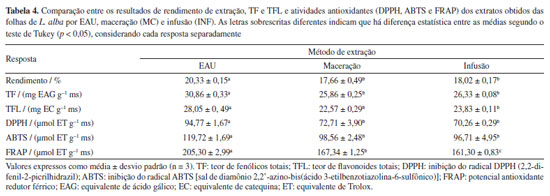
Os valores de rendimento e TF experimentais e preditos para EAU mostrados nas Tabela 3 foram muito próximos, apresentando baixos desvios relativos: 1,96 e 3,62%, considerando o rendimento e o TF, respectivamente. Esses resultados indicam que os modelos propostos explicam adequadamente os processos de extração e possuem alta capacidade de prever o rendimento e o TF, de forma simultânea, além de predizer a concentração de etanol, o tempo de extração e a relação solvente para sólido mais adequada para a EAU.22,29 Comparação entre EAU, extração por maceração e extração por infusão A Tabela 4 mostra a comparação entre os resultados de rendimento, TF e TFL dos extratos obtidos das folhas de L. alba por EAU (nas condições de extração otimizadas), maceração e infusão.
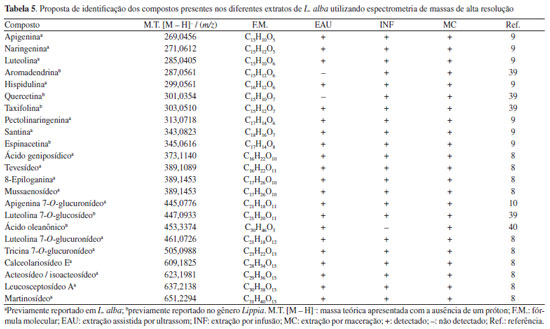
Através da Tabela 4 pode ser observado que os valores de rendimento, de TF e de TFL dos extratos L. alba foram influenciados pelos diferentes métodos de extração de acordo com suas respectivas condições experimentais, destacando o extrato EAU como aquele que apresentou os maiores valores destes três resultados em comparação aqueles da maceração e infusão. Em geral, esses resultados apresentados pelos extratos EAU em comparação as técnicas convencionais (Tabela 4) podem ser atribuídos, principalmente, ao efeito de cavitação acústica. Este efeito favorece a destruição da parede celular vegetal, facilitando assim a entrada do solvente na matriz e a liberação dos compostos em seu interior, intensificando, assim, a transferência de massa do processo de extração.7,27,30 Diversos estudos mostram que a EAU apresenta melhores resultados de recuperação em comparação a diferentes técnicas de extração.19,31-33 O extrato otimizado de EAU das folhas de Piperbetle, por exemplo, resultou em maiores valores de rendimento de extração, TF e TFL em comparação ao da maceração.19 O extrato obtido por EAU a partir de Punica granatum apresentou maior TF em comparação aos extratos obtidos por decocção e maceração a partir dessa espécie.31 Mašković et al.32 relataram o maior TF do extrato de EAU obtido de Lavatera thuringiaca quando comparado aos extratos de maceração, Soxhlet e MAE. Maiores resultados de TF e TFL do extrato preparado por EAU, em comparação aos de maceração e Soxhlet, também foram relatados em um estudo com as flores de Opuntia ficus-indica.33 Em um trabalho realizado por Iftikhar et al.,34 o extrato obtido a partir de Secale cereale por EAU apresentou maiores valores de TF e TFL em comparação ao extrato obtido por maceração convencional, empregando condições de extração semelhantes. Na Tabela 4 estão mostrados também os resultados antioxidantes (DPPH, ABTS e FRAP) apresentados pelos extratos de ultrassom, maceração e infusão. Observa-se que o extrato de L. alba obtido por EAU apresentou atividades antioxidantes significativamente maiores comparado aos extratos de maceração e infusão. Esses dados corroboram os resultados de TF e TFL desses extratos, observando-se uma correlação direta entre eles e os valores das atividades antioxidantes observadas.32,35 A forte correlação entre os valores de TF e/ou TFL e as atividades antioxidantes de extratos vegetais foi relatada anteriormente por diferentes autores.35-38 Em geral, diversos artigos têm relatado as vantagens da EAU em comparação às técnicas convencionais, que contribuem para a recuperação de compostos antioxidantes de matrizes vegetais.7,19,27,34 Brahmi et al.33 relataram as maiores atividades antioxidantes (FRAP e ABTS) apresentadas pelo extrato das flores da espécie Opuntia ficus-indica obtido por EAU em comparação ao extrato de Soxhlet. O extrato de Limonium sinuatum obtido por EAU apresentou maior atividade antioxidante (478,98 µmol ET g-1 ms) em comparação aos extratos de maceração (442,31 µmol ET g-1 ms) e Soxhlet (221,96 µmol ET g-1 ms).7 Iftikhar et al.34 relataram que o extrato de EAU obtido do farelo de centeio resultou em maior atividade antioxidante em comparação ao de maceração. De forma geral, os resultados fitoquímicos e antioxidantes apresentados pelo extrato preparado por EAU a partir das folhas de L. alba, mostram o potencial dessa espécie como uma importante fonte de compostos fenólicos bioativos. Apesar desses resultados, é importante mencionar que o extrato de EAU apresentou resultados de rendimento, TF, TFL e atividades antioxidantes menores em comparação aqueles obtidos através dos métodos de micro-ondas, decocção e Soxhlet relatados no estudo realizado por Jesus et al.9 com extratos de L. alba. Isso pode estar relacionado ao mecanismo envolvido na extração por micro-ondas, além do uso de temperaturas mais elevadas nesta técnica e nas técnicas de decocção e Soxhlet, podendo reduzir a viscosidade e a tensão superficial do solvente extrator e facilitar a sua penetração na matriz vegetal e a solubilização dos compostos químicos. Adicionalmente, o maior tempo de extração utilizado na extração por Soxhlet pode ter favorecido os melhores resultados apresentados por esta técnica em comparação ao extrato de EAU.9 Desta forma, este estudo fornece informações complementares e relevantes que ampliam o conhecimento sobre metodologias de extração utilizadas para a recuperação de compostos fenólicos das folhas de L. alba. Proposta de identificação dos compostos químicos presentes em diferentes extratos de L. alba As estruturas dos compostos presentes nos extratos de L. alba foram propostas com base nas análises por espectrometria de massas de alta resolução (FT-Orbitrap MS) por meio da infusão direta das amostras. Essa análises possibilitaram a obtenção das massas precisas dos principais íons negativos [M - H]- detectados nas amostras (Figura 4S, Material Suplementar), as quais foram convertidas em fórmulas moleculares.14 A Tabela 5 mostra as massas teóricas dos íons identificados em ordem crescente e as correspondentes fórmulas moleculares atribuídas.
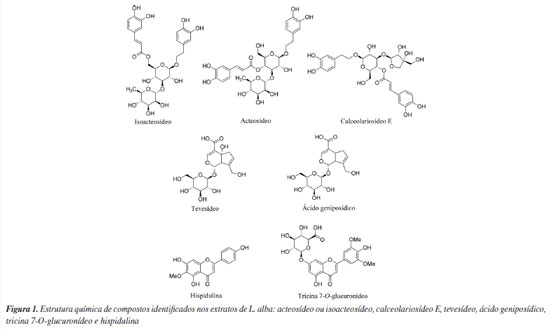
As estruturas químicas dos metabólitos foram propostas com base na comparação dos dados químicos obtidos neste trabalho com aqueles disponíveis na literatura para identificação de compostos químicos presentes em extratos de L. alba e/ou diferentes espécies do gênero Lippia.8-10,39-41 Assim, foi possível propor a identificação estrutural de derivados de iridoides, terpenoides, ácidos fenólicos, fenilpropanoides e flavonoides presentes nos extratos de L. alba (Tabela 5). Na Figura 1 estão mostradas as estruturas dos compostos referentes aos principais íons presentes nos extratos, sendo eles: acteosídeo ou isoacteosídeo, calceolariosídeo E, tevesídeo, ácido geniposídico, tricina 7-O-glucuronídeo e hispidulina.
Fenilpropanoides, flavonoides e iridoides têm mostrado diversas atividades biológicas, incluindo atividades antioxidantes. O composto acteosídeo tem efeitos antioxidantes, anti-inflamatórios, neuroprotetoras, hepatoprotetoras, anticâncer e antidiabéticas relatados na literatura.42-44 A hispidulina demonstrou importantes atividades anticâncer, anti-inflamatória, tripanocida, leishmanicida e antiepiléptica.45-47 Iridoides demonstraram atividades biológicas promissoras, como propriedades antioxidantes, antitumorais, antifúngicas, antivirais, anticâncer, antidiabéticas, hepatoprotetoras, anti-inflamatórias, neuroprotetoras e antileishmania.48-51 Portanto, os perfis metabólitos encontrados nos extratos de L. alba demonstram o grande potencial biológico e econômico desta espécie.
CONCLUSÕES Neste trabalho, foi otimizado, de forma simultânea, o rendimento de extração e o conteúdo de fenólicos totais das folhas de L. alba por EAU, empregando metodologia de superfície de resposta. A concentração de etanol e o tempo de extração foram as variáveis que mais influenciaram no valor do rendimento e no TF dos extratos obtidos por EAU. A técnica de EAU se mostrou mais eficiente que as técnicas de extração convencionas, uma vez que apresentou maiores resultados de rendimento de extração, TF e TFL e atividades antioxidantes em comparação aos extratos obtidos por maceração e infusão. As atividades antioxidantes apresentadas pelos extratos supostamente estão relacionadas à presença de diversos compostos fenólicos presentes nos extratos dessa espécie como ácidos fenólicos, fenilpropanoides e flavonoides, além de iridoides, como sugerido pelas análises de espectrometria de massas de alta resolução. Os resultados obtidos sugerem que essa espécie pode ser utilizada como fonte importante de compostos fenólicos antioxidantes para as indústrias alimentícias, cosméticas e farmacêuticas, especialmente quando a técnica de ultrassom for utilizada como método de extração. Adicionalmente, este trabalho traz informações novas importantes que podem contribuir para o desenvolvimento de futuros estudos relacionados à exploração do potencial biológico dos compostos fenólicos desta espécie.
MATERIAL SUPLEMENTAR Imagens e dados adicionais utilizados neste trabalho estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Os autores informam que há um conjunto de dados importantes na seção Material Suplementar. Caso haja interesse em detalhes experimentais, favor entrar em contato com o autor de correspondência.
AGRADECIMENTOS Os autores agradecem o Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), ao Programa INCT-CBIP (MCTI/CNPq/CAPES/FAPESP No. 16/2014 - No. do Processo: 465357/2014-8) e a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo apoio financeiro e também ao Centro de Laboratórios de Química Multiusuários da Universidade Federal de Sergipe (CLQM/UFS) pela infraestrutura disponibilizada para a realização de diversos experimentos.
CONTRIBUIÇÕES DO AUTOR Raphael A. de Jesus foi responsável pela conceituação, metodologia, análise formal, investigação, redação-rascunho original, redação-revisão e edição e visualização. Julio M. A. Oliveira foi responsável pela metodologia e análise formal. José M. da Silva foi responsável pela análise formal. Wenes R. da Silva foi responsável pela metodologia, análise formal e investigação. Alberto Wisniewski Jr. foi responsável pela redação-revisão e edição, supervisão e aquisição de recursos. José C. F. S. Filho foi responsável pela metodologia e análise formal. Arie F. Blank foi responsável pela conceituação, metodologia, investigação e supervisão. Daniel A. de Souza foi responsável pela metodologia, análise formal e investigação. Elma R. S. A. Wartha foi responsável pela metodologia, validação, investigação, supervisão e gerenciamento. Paulo C. L. Nogueira foi responsável pelos recursos, redação-revisão e edição, gerenciamento e aquisição de recursos. Valéria R. S. Moraes foi responsável pela conceituação, redação-revisão e edição, supervisão, gerenciamento e aquisição de recursos.
REFERÊNCIAS 1. Zengin, G.; Uysal, A.; Aktumsek, A.; Mocan, A.; Mollica, A.; Locatelli, M.; Custodio, L.; Neng, N. R.; Nogueira, J. M. F.; Aumeeruddy-Elalfi, Z.; Mahomoodally, M. F.; Biomed. Pharmacother. 2017, 87, 27. [Crossref] 2. de Oliveira, A. C.; Valentim, I. B.; Goulart, M. O. F.; Silva, C. A.; Bechara, E. J. H.; Trevisan, M. T. S.; Quim. Nova 2009, 32, 689. [Link] acessado em junho 2025 3. Ribeiro, J. S.; Santos, M. J. M. C.; Silva, L. K. R.; Pereira, L. C. L.; Santos, I. A.; Lannes, S. C. S.; da Silva, M. V.; Meat Sci. 2019, 148, 181. [Crossref] 4. Zhou, T.; Xu, D.-P.; Lin, S.-J.; Li, Y.; Zheng, J.; Zhou, Y.; Zhang, J.-J.; Li, H.-B.; Molecules 2017, 22, 306. [Crossref] 5. Vasconcelos, S. M. L.; Goulart, M. O. F.; Moura, J. B. F.; Manfredini, V.; Benfato, M. S.; Kubota, L. T.; Quim. Nova 2007, 30, 1323. [Crossref] 6. Sousa, E. O.; Miranda, C. M. B. A.; Nobre, C. B.; Boligon, A. A.; Athayde, M. L.; Costa, J. G. M.; Ind. Crops Prod. 2015, 70, 7. [Crossref] 7. Xu, D.-P.; Zheng, J.; Zhou, Y.; Li, Y.; Li, S.; Li, H.-B.; Food Chem. 2017, 217, 552. [Crossref] 8. Timóteo, P.; Karioti, A.; Leitão, S. G.; Vincieri, F. F.; Bilia, A. R.; Food Chem. 2015, 175, 366. [Crossref] 9. Jesus, R. A.; Oliveira, J. M. A.; Silva, J. M.; Fraga, M. O.; Silva, W. R.; Wisniewski Jr., A.; Sá Filho, J. C. F.; Blank, A. F.; Souza, D. A.; Wartha, E. R. S. A.; Nogueira, P. C. L.; Moraes, V. R. S.; Food Chem. 2025, 474, 143166. [Crossref] 10. Gomes, A. F.; Almeida, M. P.; Leite, M. F.; Schwaiger, S.; Stuppner, H.; Halabalaki, M.; Amaral, J. G.; David, J. M.; Food Chem. 2019, 273, 186. [Crossref] 11. Camêlo, L. C. A.; Blank, A. F.; Ehlert, P. A. D.; Carvalho, C. R. D.; Arrigoni-Blank, M. F.; Mattos, J.; Sci. Plena 2011, 7, 050201. [Link] acessado em junho 2025 12. Pascual, M. E.; Slowing, K.; Carretero, E.; Mata, D. S.; Villar, A.; J. Ethnopharmacol. 2001, 76, 201. [Crossref] 13. Jesus, R. A.; Prado, V. M. J.; Pinto, V. S.; Silva, V. R.; Santos, L. S.; Nogueira, P. C. L.; Navickiene, S.; PereiraFilho, E. R.; Blank, A. F.; Bezerra, D. P.; Soares, M. B. P.; Seidl, C.; Cardoso, C. L.; Moraes, V. R. S.; J. Braz. Chem. Soc. 2019, 30, 978. [Crossref] 14. Nascimento, P. E. S.; Prado, V. M. J.; Jesus, R. A.; Silva, W. R.; Wisniewski Jr., A.; Sá Filho, J. C. F.; Blank, A. F.; Souza, D. A.; Wartha, E. R. S. A.; Nogueira, P. C. L.; Moraes, V. R. S.; J. Braz. Chem. Soc. 2023, 34, 937. [Crossref] 15. Prado, V. M. J.; Jesus, R. A.; Oliveira, J. M. A.; Pereira, C. S. A.; Blank, A. F.; Pereira-Filho, E. R.; Cass, Q. B.; Lima, J. M.; Ferreira, A. G.; Nogueira, P. C. L.; Moraes, V. R. S.; J. Braz. Chem. Soc. 2021, 32, 385. [Crossref] 16. Barba, F. J.; Zhu, Z.; Koubaa, M.; Sant'ana, A. S.; Orlien, V.; Trends Food Sci. Technol. 2016, 49, 96. [Crossref] 17. Zhu, Z.; He, J.; Liu, G.; Barba, F. J.; Koubaa, M.; Ding, L.; Bals, O.; Grimi, N.; Vorobiev, E.; Innovative Food Sci. Emerging Technol. 2016, 33, 1. [Crossref] 18. Veličković, V.; Đurović, S.; Radojković, M.; Cvetanović, A.; ŠvarcGajić, J.; Vujić, J.; Trifunović, S.; Mašković, P. Z.; J. Supercrit. Fluids 2017, 128, 331. [Crossref] 19. Ali, A.; Lim, X. Y.; Chong, C. H.; Mah, S. H.; Chua, B. L.; LWT 2018, 89, 681. [Crossref] 20. Barros Neto, B.; Scarminio I. S.; Bruns, R. E.; Como Fazer Experimentos: Pesquisa e Desenvolvimento na Ciência e na Indústria, 3ª ed.; Bookman: Porto Alegre, 2010. 21. Pereira, F. M. V.; Pereira-Filho, E. R.; Quim. Nova 2018, 41, 1061. [Crossref] 22. Nabet, N.; Gilbert-López, B.; Madani, K.; Herrero, M.; Ibáñez, E.; Mendiola, J. A.; Ind. Crops Prod. 2019, 129, 395. [Crossref] 23. Jesus, R. A.; Silva, W. R.; Wisniewski Jr., A.; Nascimento, L. F. A.; Blank, A. F.; Souza, D. A.; Wartha, E. R. S. A.; Nogueira, P. C. L.; Moraes, V. R. S.; Phytochem. Anal. 2024, 35, 889. [Crossref] 24. Minitab®, version 19; Stat College, PA, EUA, 2019. 25. Excel, version 21; Microsoft, WA, EUA, 2021. 26. Past, version 3.0; Oslo, Noruega, 2022. 27. Luo, X.; Cui, J.; Zhang, H.; Duan, Y.; Zhang, D.; Cai, M.; Chen, G.; Ind. Crops Prod. 2018, 112, 296. [Crossref] 28. Alara, O. R.; Abdurahman, N. H.; Ali, H. A.; Zain, N. M.; Future Foods 2021, 3, 100035. [Crossref] 29. Ez zoubi, Y.; Fadil, M.; Bousta, D.; Lalami, A. E.; Lachkar, M.; Farah, A.; J. Chem. 2021, 2021, 8830902. [Crossref] 30. Chemat, F.; Rombaut, N.; Sicaire, A.; Meullemiestre, A.; Fabiano-Tixier, A.; Abert-Vian, M.; Ultrason. Sonochem. 2017, 34, 540. [Crossref] 31. Castro-López, C.; Ventura-Sobrevilla, J. M.; González-Hernández, M. D.; Rojas, R.; Ascacio-Valdés, J. A.; Aguilar, C. N.; Martínez-Ávila, G. C. G.; Food Chem. 2017, 237, 1139. [Crossref] 32. Mašković, P. Z.; Veličković, V.; Đurović, S.; Zeković, Z.; Radojković, M.; Cvetanović, A.; Švarc-Gajić, J.; Mitić, M.; Vujić, J.; Phytomedicine 2018, 38, 118. [Crossref] 33. Brahmi, F.; Blando, F.; Sellami, R.; Mehdi, S.; De Bellis, L.; Negro, C.; Haddadi-Guemghar, H.; Madani, K.; Makhlouf-Boulekbache, L.; Ind. Crops Prod. 2022, 184, 114977. [Crossref] 34. Iftikhar, M.; Zhang, H.; Iftikhar, A.; Raza, A.; Begum, N.; Tahamina, A.; Syed, H.; Khan, M.; Wang, J.; LWT 2020, 134, 110243. [Crossref] 35. Santos, P. H.; Ribeiro, D. H. B.; Micke, G. A.; Vitali, L.; Hense, H.; J. Supercrit. Fluids 2019, 145, 219. [Crossref] 36. Lee, T. H.; Lee, C. H.; Ong, P. Y.; Wong, S. L.; Hamdan, N.; Ya'akob, H.; Azmi, N. A.; Khoo, S. C.; Zakaria, Z. A.; Cheng, K.-K.; S. Afr. J. Bot. 2022, 148, 170. [Crossref] 37. Irakli, M.; Chatzopoulou, P.; Ekateriniadou, L.; Ind. Crops Prod. 2018, 124, 382. [Crossref] 38. Zeković, Z.; Cvetanović, A.; Švarc-Gajić, J.; Gorjanović, S.; Sužnjević, D.; Mašković, P.; Savić, S.; Radojković, M.; Đurović, S.; Ind. Crops Prod. 2017, 108, 423. [Crossref] 39. Funari, C. S.; Eugster, P. J.; Martel, S.; Carrupt, P.-A.; Wolfender, J.-L.; Silva, D. H. S.; J. Chromatogr. A 2012, 1259, 167. [Crossref] 40. Funari, C. S.; Almeida, L.; Passalacqua, T. G.; Martinez, I.; Ambrósio, D. L.; Cicarelli, R. M. B.; Silva, D. H. S.; Graminha, M. A. S.; Acta Amazonica 2016, 46, 411. [Crossref] 41. Funari, C. S.; Passalacqua, T. G.; Rinaldo, D.; Napolitano, A.; Festa, M.; Capasso, A.; Piacente, S.; Pizza, C.; Young, M. C. M.; Durigan, G.; Silva, D. H. S.; Phytochemistry 2011, 72, 2052. [Crossref] 42. Alipieva, K.; Korkina, L.; Orhan, I. E.; Georgiev, M. I.; Biotechnol. Adv. 2014, 32, 1065. [Crossref] 43. Fan, Y.; Xu, C.; Li, J.; Zhang, L.; Yang, L.; Zhou, Z.; Zhu, Y.; Zhao, D.; Ind. Crops Prod. 2018, 124, 59. [Crossref] 44. Wu, L.; Huang, W.; Peng, K.; Wang, Y.; Chen, Q.; Lu, B.; Food Chem. 2023, 414, 135682. [Crossref] 45. Lin, T.-Y.; Lu, C.-W.; Wang, C.-C.; Lu, J. F.; Wang, S.-J.; Toxicol. Appl. Pharmacol. 2012, 263, 233. [Crossref] 46. Liu, K.; Zhao, F.; Yan, J.; Xia, Z.; Jiang, D.; Ma, P.; Life Sci. 2020, 259, 118395. [Crossref] 47. Patel, K.; Patel, D. K.; J. Tradit. Complementary Med. 2017, 7, 360. [Crossref] 48. Gonçalves, G. A.; Eifler-Lima, V. V.; von Poser, G. L.; Phytochem. Rev. 2022, 21, 101. [Crossref] 49. Hennebelle, T.; Sahpaz, S.; Gressier, B.; Joseph, H.; Bailleul, F.; Phytother. Res. 2008, 22, 256. [Crossref] 50. Wang, L.; Meng, X.; Zhou, H.; Liu, Y.; Zhang, Y.; Liang, H.; Hou, G.; Kang, W.; Liu, Z.; Heliyon 2023, 9, e16518. [Crossref] 51. Liu, W.; Wu, P.; Song, Z.; Nie, F.; Zhang, L.; Lee, D.; Nakajima, A.; Xu, J.; Guo, Y.; Phytochemistry 2023, 212, 113720. [Crossref]
Editor responsável pelo artigo: Jorge M. David |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Química Nova
Publicações da Sociedade Brasileira de Química
Caixa Postal: 26037
05513-970 São Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access