Artigo
|
|
| Fios biodegradáveis de quitosana com membrana testácea do ovo de galinha (gallus gallus domesticus) reticulados com riboflavina Biodegradable chitosan threads with chicken egg test membrane (gallus gallus domesticus) crosslinked with riboflavin |
|
Lucas C. OliveiraI,* I. Programa de Pós-Graduação em Ciência e Engenharia de Materiais, Universidade Federal de Campina Grande, 58429-900 Campina Grande - PB, Brasil Recebido: 03/06/2025 *e-mail: lucas.cordeiro@certbio.ufcg.edu.br Absorbable sutures are used to provide temporary support to tissue during healing, degrading in the body and not requiring surgical removal. However, some have low biocompatibility, are difficult to handle and undergo uncontrolled degradation. Natural biomaterials, such as chitosan and egg testis membrane, appear as promising alternatives. This study evaluated the effect of adding testis membrane powder to biodegradable suture threads, analyzing physicochemical, mechanical and biological properties, in addition to the use of riboflavin and ultraviolet (UV) light as crosslinking agents. The samples were subjected to Fourier transform infrared spectroscopy (FTIR), energy dispersive spectroscopy (EDS), tensile strength, swelling degree and cytotoxicity tests. FTIR spectra confirmed the formation of crosslinks (C-O-C and C=N), which increased the structural stability of the threads. EDS spectroscopy revealed a higher concentration of nitrogen in the crosslinked samples. Morphological analyses indicated denser and more uniform surfaces, and crosslinking improved mechanical properties. The incorporation of testate membrane powder into chitosan threads, together with the crosslinking process, demonstrated significant improvements in the studied properties, indicating the potential of these threads in absorbable sutures. INTRODUÇÃO Os biomateriais inovadores têm despertado crescente interesse da comunidade científica como resposta às demandas da sociedade moderna por soluções mais sustentáveis, eficazes e economicamente viáveis. Esses materiais, muitas vezes derivados de fontes naturais, destacam-se por sua biocompatibilidade, biodegradabilidade e por sua contribuição à redução do impacto ambiental, além de oferecerem alternativas promissoras para aplicações em saúde humana. Dentro desse contexto, observa-se uma busca constante por materiais com características funcionais otimizadas para uso em dispositivos biomédicos, como suturas, curativos, scaffolds e sistemas de liberação de fármacos.1-3 Dentre os biomateriais de origem natural, a quitosana ocupa uma posição de destaque devido à sua versatilidade estrutural, morfológica e funcional. Obtida a partir da desacetilação da quitina, presente no exoesqueleto de crustáceos, a quitosana apresenta propriedades como atividade bacteriostática, biocompatibilidade, atoxicidade e biodegradabilidade. Essas características tornam-na amplamente utilizada na engenharia de tecidos, medicina regenerativa e em sistemas de sutura biodegradável. Além disso, a capacidade de modificação química e a combinação com outros materiais reforçam seu potencial para aplicações clínicas mais complexas.4,5 Nesse cenário, destaca-se a membrana testácea, também conhecida como membrana da casca do ovo, um biomaterial de origem aviária ainda pouco explorado na literatura científica. Essa membrana desempenha papel essencial na formação da casca do ovo, sendo composta majoritariamente por colágeno tipo I,6 além de glicosaminoglicanos6,7 e proteínas estruturais.8 Sua riqueza em componentes bioativos lhe confere propriedades interessantes para aplicações biomédicas, como regeneração tecidual, cicatrização de feridas e suporte para proliferação celular.6,7 No entanto, a fragilidade intrínseca da membrana e sua variabilidade estrutural limitam seu uso direto, demandando estratégias de processamento e reforço que favoreçam sua integração com outros materiais poliméricos, como a quitosana. A associação entre a quitosana e o colágeno da membrana testácea representa uma abordagem inovadora e sinérgica para o desenvolvimento de suturas biodegradáveis com desempenho superior.9,10 O colágeno é uma proteína estrutural amplamente distribuída nos tecidos conjuntivos do corpo humano, responsável pela integridade mecânica da pele, ossos e cartilagens. Sua incorporação em biomateriais têm demonstrado impactos positivos na bioatividade e na interação célula-matriz, embora seu uso combinado com quitosana em fios de sutura ainda configure uma área de pesquisa incipiente e com considerável potencial científico.11-14 Paralelamente, estratégias de reticulação química vêm sendo empregadas para aumentar a resistência mecânica e a estabilidade estrutural de biomateriais poliméricos. Nesse contexto, destaca-se a riboflavina, uma molécula fotossensível capaz de promover reações de reticulação quando ativada por radiação ultravioleta (UV). A riboflavina, ao gerar radicais livres sob irradiação, induz a formação de ligações covalentes entre as fibrilas de colágeno, resultando em redes poliméricas mais coesas e mecanicamente resistentes. Tal abordagem tem sido aplicada no tratamento da ceratocone, uma doença ocular progressiva e não inflamatória que afeta a córnea, a camada transparente e externa do olho. Essa deformação pode distorcer a visão, causando visão embaçada, sensibilidade à luz e aumento de miopia e astigmatismo.15 Apesar dos avanços no desenvolvimento de suturas baseadas em quitosana, ainda há escassez de estudos que explorem a sinergia entre este polímero e o colágeno de origem alternativa, como o presente na membrana testácea do ovo de galinha. Ademais, o uso da riboflavina como agente reticulante nesse tipo de sistema ainda é pouco abordado na literatura, representando uma lacuna importante no conhecimento técnico-científico.16-19 Diante disto, justifica-se a presente pesquisa, que visa desenvolver um material biodegradável para aplicação como sutura, combinando quitosana e pó da membrana testácea, associado ao uso da riboflavina como reticulante. Este estudo possui relevância científica por contribuir com novas abordagens na engenharia de biomateriais e, ao mesmo tempo, relevância social, ao propor alternativas sustentáveis e acessíveis para dispositivos médicos de uso comum. Assim, o objetivo deste trabalho foi avaliar a influência da adição do pó da membrana testácea em fios de quitosana biodegradáveis para aplicação como suturas, investigando suas propriedades físico-químicas, mecânicas e biológicas, além de estudar o efeito da riboflavina como agente reticulante.
PARTE EXPERIMENTAL Materiais Quitosana de massa molecular média (310 kDa), com grau de desacetilação de aproximadamente 90%, foi fornecida pelo Laboratório de Avaliação e Desenvolvimento de Biomateriais do Nordeste - CERTBIO (Campina Grande, PB, Brasil), sendo obtida conforme metodologia desenvolvida e patenteada20 por nosso grupo de pesquisa. Cascas de ovos foram obtidas de resíduos domésticos da região de Campina Grande, PB, Brasil. Ácido láctico e hidróxido de sódio (P.A.) foram adquiridos da Dinâmica® (Indaiatuba, SP, Brasil). Álcool metílico foi fornecido pela Neon® (Suzano, SP, Brasil) e riboflavina (C17H20N4O6), de massa molar 376,36 g mol-1, foi adquirida da Eyepharma® (São Paulo, SP, Brasil). Métodos Inicialmente, foi preparada uma solução de quitosana 3% (m/v) em ácido acético 1% (v/v), sob agitação mecânica (600 rpm) por 2 h, a temperatura ambiente (25 ºC). A quitosana utilizada apresentava grau de desacetilação superior a 75% e massa molar média (aproximadamente 150-300 kDa), características que favorecem sua solubilização em meio ácido e a formação de filmes e fibras com propriedades mecânicas adequadas para aplicações biomédicas. Paralelamente, foi realizado o preparo do pó da membrana testácea do ovo de galinha, rica em colágeno do tipo I. Para isso, as cascas de ovos foram inicialmente lavadas com água destilada para remoção de impurezas superficiais, seguidas da separação manual da membrana testácea. As membranas foram então imersas em solução de ácido acético 3% (v/v) por 24 h, com o objetivo de solubilizar os resíduos de carbonato de cálcio, promovendo maior pureza da matriz proteica. Após esse período, as membranas foram submetidas à secagem em estufa a 70 ºC por 24 h. O material seco foi macerado com auxílio de nitrogênio líquido, visando preservar a integridade das estruturas proteicas e facilitar a pulverização. Em seguida, o pó foi peneirado em malha com abertura de 325 mesh (aproximadamente 44 µm), obtendo-se um material fino e homogêneo. Para a produção dos fios utilizou-se uma bomba de infusão com vazão controlada de 45 mL h-1, acoplada a uma seringa de 20 mm de diâmetro de saída, para a extrusão do material imerso em uma solução coagulante de hidróxido de sódio (2 mol), permanecendo nesta solução por 24 h. Após o período de coagulação, os fios foram retirados e submetidos a um processo de lavagem com água destilada e álcool metílico, visando à remoção do excesso de hidróxido de sódio. Os fios foram secos a temperatura ambiente (25 ºC) por 2 h. Após a formação dos fios, estes foram submetidos ao processo de reticulação fotoiniciada com riboflavina (vitamina B2), com o objetivo de aprimorar suas propriedades físico-químicas e mecânicas. O procedimento consistiu na imersão dos fios em solução aquosa de riboflavina (concentração otimizada experimentalmente) seguida de exposição à luz ultravioleta (UV) com comprimento de onda de 365 nm por 30 min. A riboflavina atua como fotoiniciador na presença de radiação UV, promovendo a geração de espécies reativas capazes de induzir a formação de ligações cruzadas entre os grupos funcionais das cadeias poliméricas da quitosana e do colágeno. Esse tratamento promove a reticulação intermolecular, resultando em uma rede polimérica tridimensional com maior integridade estrutural, o que contribui para o aumento da resistência mecânica, a redução da solubilidade em meios aquosos e a modulação da taxa de degradação do biomaterial. Além disso, o uso da riboflavina como agente reticulante apresenta vantagens em termos de biocompatibilidade, uma vez que se trata de um composto natural, fotossensível e de baixa toxicidade, sendo amplamente utilizado em aplicações biomédicas, como na reticulação de colágeno em terapias oftalmológicas e em engenharia de tecidos. Esse tratamento teve como objetivo otimizar as propriedades mecânicas e estruturais dos fios. Os fios produzidos foram codificados como descrição detalhada na Tabela 1.

Caracterizações As análises físico-químicas, morfológicas, mecânicas, térmicas e biológicas dos fios poliméricos foram conduzidas com o objetivo de investigar a influência das diferentes concentrações de membrana testácea incorporada (5 e 10%) nas propriedades do material final. A caracterização estrutural foi realizada por espectroscopia na região do infravermelho com transformada de Fourier (FTIR), utilizando o equipamento Spectrum 400 (PerkinElmer), com varredura espectral na faixa de 4000 a 600 cm-1 e resolução de 4 cm-1. Essa técnica visou identificar as bandas características das interações químicas entre a quitosana e os constituintes da membrana testácea do ovo, como colágeno e proteínas estruturais. A análise morfológica foi conduzida por meio de microscopia eletrônica de varredura (MEV) (Hitachi, modelo TM-1000), com ampliações de 500× e 1000×, a fim de observar a homogeneidade superficial e a disposição das fibras após o processo de reticulação. A composição elementar foi avaliada por espectroscopia de energia dispersiva de raios X (EDS), acoplada ao MEV, permitindo verificar a presença de elementos característicos da matriz polimérica e da carga proteica adicionada. Para avaliação do desempenho mecânico, foram realizados ensaios de tração utilizando uma máquina universal de testes (Instron, série 3366), com velocidade de deformação de 5 mm min-1, conforme normas técnicas aplicáveis para materiais biomédicos fibrosos. As propriedades analisadas incluíram tensão máxima, módulo de elasticidade e alongamento na ruptura. A biodegradabilidade dos fios foi investigada em solução tampão fosfato (PBS, pH 7,4) a 37 ºC, ao longo de 21 dias, conforme a norma ASTM F1635-11.21 O grau de degradação foi quantificado pela perda de massa (%), segundo a Equação 1: 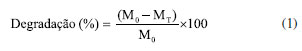 onde M0 representa a massa inicial e MT a massa após 21 dias de imersão. A capacidade de absorção foi estimada pelo grau de intumescimento, determinado a partir da variação do peso dos fios após imersão em água destilada por 24 h, sob temperatura controlada de 25ºC. O grau de intumescimento foi calculado conforme Equação 2:  onde Mi é a massa intumescida e Ms a massa seca. A análise de citotoxicidade in vitro foi realizada de acordo com a norma ISO 10993-5,22 utilizando linhagem celular L929 (fibroblastos murinos), por meio do ensaio colorimétrico MTT (brometo de 3-4,5-dimetil-tiazol-2-il-2,5-difeniltetrazólio), após exposição a extratos dos fios por 24 h. A viabilidade celular foi expressa em porcentagem relativa ao grupo controle negativo (sem contato com o biomaterial). Valores superiores a 70% de viabilidade celular indicam ausência de efeito citotóxico significativo, conforme a norma.
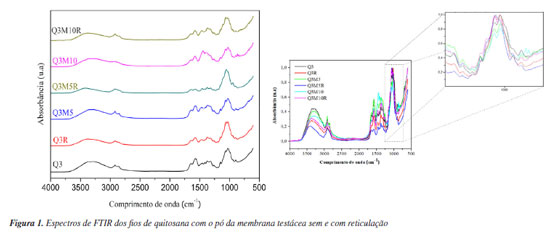
RESULTADOS E DISCUSSÃO Análises físico-químicas Os espectros de infravermelho apresentados na Figura 1 para os fios de quitosana com o pó da membrana testácea do ovo sem e com reticulação, evidencia as principais bandas vibracionais associadas às estruturas desses biopolímeros. Observa-se, no espectro, a presença de uma banda em 1027 cm-1, atribuída à vibração da ligação C-O, característica tanto da quitosana quanto do colágeno presente no pó da membrana testácea do ovo, corroborando com a literatura.23,24
A análise dos espectros revelou um deslocamento da banda de absorção em torno de 1654 cm-1 nas amostras de quitosana incorporadas com o pó da membrana testácea do ovo. Tal banda é comumente associada ao estiramento do grupo imina (C=N), e sua mudança para menores números de onda (red shift) sugere a ocorrência de novas interações intermoleculares entre os constituintes do sistema. A presença de colágeno, principal componente proteico da membrana testácea do ovo, pode favorecer a formação de ligações de hidrogênio e interações eletrostáticas com os grupos funcionais da quitosana, tais como aminas e hidroxilas. Tais interações têm o potencial de alterar a estrutura tridimensional da matriz polimérica, promovendo maior organização das cadeias, além de influenciar diretamente as propriedades físico-químicas e mecânicas do material final. Essa reorganização estrutural é indicativa de um sistema compatível, com possível sinergia entre os biopolímeros envolvidos, o que pode repercutir positivamente na estabilidade, intumescimento e biodegradabilidade dos fios, além de potencialmente aprimorar seu desempenho em aplicações biomédicas. O pico em 3329 cm-1 é atribuído à vibração de estiramento do grupo O-H, aparecendo como uma banda larga devido ao acoplamento com o grupo N-H, reforçando a presença de ligações de hidrogênio entre os biopolímeros.23 As bandas características do colágeno também foram observadas nos espectros, especialmente as amidas I, II e III, com picos em 1658, 1540 e 1240 cm-1, respectivamente.25 Esses picos indicam que as cadeias polipeptídicas do colágeno mantiveram sua integridade estrutural. A amida I, localizada entre 1700-1600 cm-1, está associada ao estiramento da carbonila (C=O), enquanto a amida II, entre 1550-1500 cm-1, corresponde à deformação da ligação N-H. A amida III, geralmente de menor intensidade entre 1350-1250 cm-1, é atribuída ao estiramento C-N e à deformação N-H.26 Além disso, uma banda intensa e larga entre 3600-3200 cm-1 foi observada, atribuída aos grupos hidroxila (O-H) das moléculas de água adsorvida, sobreposta à banda N-H da amida I (3360-3320 cm-1).23,25 Picos em 2850 e 1450 cm-1, associados ao estiramento do grupo -CH2 e aos anéis pirrolidínicos da prolina, reforçam a presença de colágeno, uma vez que a prolina é abundante nas fibras colágenas. A presença de grupos carboxilato dissociados (-COO-) foi confirmada pela banda em 1330 cm-1, associada ao estiramento assimétrico desses grupos, enquanto o pico em 1090 cm-1 foi relacionado às vibrações do grupo fosfato (PO43-).23,25,26 Ao avaliar a região de 1060 cm-1, observa-se no espectro ampliado da Figura 1, o aumento da intensidade das bandas em todas as amostras após o processo de reticulação com riboflavina e luz UV. Essa região é associada às ligações C-O-C, presentes tanto na quitosana quanto no colágeno, indicando que o processo de reticulação reforça a rede estrutural do material. Esse aumento na intensidade sugere a formação de novas ligações cruzadas com as interações entre as cadeias poliméricas de quitosana e colágeno. Assim, a reticulação não apenas fortalece as propriedades mecânicas dos arcabouços, como discutido anteriormente, mas também parece influenciar diretamente a estabilidade das estruturas químicas, tornando o material mais resistente e coeso, o que é desejável para aplicações biomédicas.27 Esses resultados indicam que o processo de reticulação com riboflavina e luz UV tem impacto direto na formação e na estabilidade das ligações C-O-C e nas interações intermoleculares entre quitosana e colágeno, contribuindo para a integridade estrutural e funcionalidade dos fios desenvolvidos, corroborando os resultados da análise de resistência à tração. As imagens da Figura 2 evidenciam as características morfológicas dos fios de quitosana e do pó da membrana testácea do ovo com e sem reticulação.

Observa-se uma variação nos diâmetros dos fios, sendo que os Q3R, Q3M5R, e Q3M10R exibiram uma estrutura aparentemente mais densa e uniforme em comparação com os demais. As amostras estão em conformidade aos requisitos exigíveis pela norma ABNT NBR 13904/200328 para os fios absorvíveis do tipo 3-0 (fio sintético absorvível estéril), com valores de diâmetro variando entre 0,200 e 0,249 mm, estando com diâmetros dentro ou muito próximos da faixa exigida pela norma. Essa diferença na morfologia pode estar associada ao processo de reticulação com riboflavina e exposição à luz UV, que promoveu a formação de ligações cruzadas entre as moléculas de quitosana e colágeno, conferindo maior estabilidade estrutural aos fios.29 Além disso, a presença de pó da membrana testácea do ovo parece ter uma influência significativa na morfologia dos fios. As amostras Q3M5 e Q3M10 com 5 e 10% de pó de membrana, respectivamente, apresentaram uma superfície mais rugosa. A amostra Q3M5R apresentou um diâmetro de 0,231 mm após a reticulação, o que sugere que o processo não apenas estabiliza a matriz polimérica, mas também contribuiu para uma redução no diâmetro dos fios, mantendo a integridade dimensional. Essas características morfológicas são relevantes, pois afetam diretamente as propriedades mecânicas e a estabilidade dos fios quando aplicados em ambiente fisiológico. Na Figura 3, é possível verificar a composição química das amostras obtidas por meio da análise por espectroscopia por energia dispersiva de raios X (EDS).
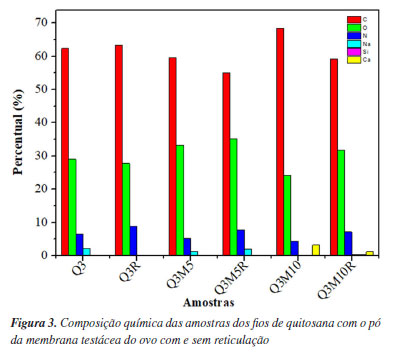
O aumento nos teores de nitrogênio (N) nas amostras Q3R, Q3M5R, e Q3M10R sugere um incremento nas ligações químicas envolvendo grupos amina da quitosana, possivelmente devido à formação de ligações cruzadas promovidas pela riboflavina e pela exposição à luz UV. A amostra Q3R, por exemplo, apresentou um teor de nitrogênio de 8,90%, significativamente superior ao teor de 6,52% da amostra Q3 não reticulada, como pode ser observado na Tabela 2, corroborando com a hipótese de que o processo de reticulação aumenta a quantidade de ligações C-N, fortalecendo a estrutura do material.
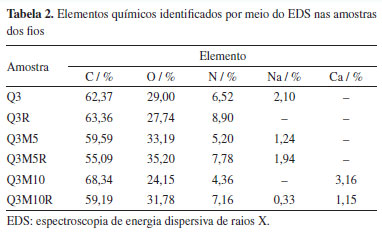
Outro aspecto importante é a presença do cálcio (Ca) nas amostras contendo pó de membrana testácea do ovo, como observado nas amostras Q3M10 e Q3M10R, o que é indicativo da incorporação de componentes inorgânicos característicos da casca do ovo. Esses elementos contribuem para a bioatividade e podem melhorar as propriedades de adesão celular dos fios, sendo especialmente relevantes para aplicações biomédicas.30,31 O aumento de cálcio, que atinge até 3,16% na amostra Q3M10, pode, por exemplo, atuar como um mediador na interação com tecidos biológicos, potencializando a integração do material com o ambiente fisiológico. Observa-se que a reticulação não apenas altera a morfologia, mas também modifica a composição química dos fios. As alterações nos níveis de oxigênio (O) e carbono (C) entre as amostras reticuladas e não reticuladas sugerem que o processo de reticulação também impacta a estrutura química da matriz polimérica, fortalecendo a rede de polímeros e possivelmente contribuindo para uma maior resistência mecânica e estabilidade térmica. Esses resultados são importantes para entender o comportamento dos fios em aplicações de sutura e potencialmente em outras áreas biomédicas que exijam biocompatibilidade e resistência ajustada. Análise mecânica Os valores máximos de resistência à tração dos fios de quitosana com adição de pó da membrana testácea do ovo, avaliados com e sem a aplicação do processo de reticulação estão apresentados na Tabela 3. Embora a reticulação com riboflavina/luz UV tenha promovido um aumento na resistência mecânica dos fios, os valores obtidos permaneceram abaixo do limite de 17,36 N estipulado pela norma ABNT NBR 13904/200328 para suturas absorvíveis tipo 3-0, com diâmetro entre 0,200 e 0,249 mm. No entanto, é importante destacar que, nesta etapa do desenvolvimento, os fios propostos foram concebidos para aplicações em regiões do corpo que não estejam sujeitas a elevada tensão mecânica, como tecidos superficiais ou em procedimentos onde o suporte estrutural exigido é temporário. Além disso, por se tratar de um material bioabsorvível, a proposta é que o fio se degrade progressivamente no organismo, acompanhando o processo de cicatrização tecidual sem necessidade de remoção. Assim, apesar de não atenderem, ainda, aos parâmetros normativos para uso em situações de maior exigência mecânica, os fios demonstram potencial promissor para aplicações específicas de baixa carga, sendo necessário, em estudos futuros, a otimização da formulação ou da arquitetura do fio (como trançado ou revestimento) para expansão de sua aplicabilidade clínica.
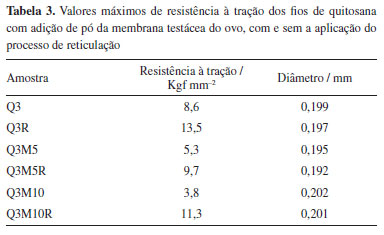
Os resultados obtidos para a resistência à tração dos fios de quitosana demonstraram influência da adição de pó da membrana testácea do ovo, bem como da aplicação do processo de reticulação. A amostra controle (Q3) apresentou resistência à tração de 8,6 Kgf mm-2, enquanto a adição de 5% (Q3M5) e 10% (Q3M10) do aditivo reduziu esse valor para 5,3 e 3,8 Kgf mm-2, respectivamente. Essa diminuição pode ser atribuída à interferência do pó nas interações intermoleculares da matriz polimérica de quitosana, promovendo pontos de tensão e, consequentemente, maior fragilidade. No entanto, após a aplicação do processo de reticulação, observou-se um aumento na resistência à tração das amostras modificadas: Q3M5R apresentou 9,7 Kgf mm-2 e Q3M10R, 11,3 Kgf mm-2. A amostra Q3R, contendo apenas quitosana reticulada, atingiu 13,5 Kgf mm-2, o maior valor observado entre todas as condições testadas. Esse comportamento evidencia que a reticulação atua como reforço estrutural, promovendo maior coesão entre as cadeias poliméricas, mesmo na presença do material particulado da membrana, atribuído à formação de ligações covalentes adicionais nas cadeias de quitosana induzidas pela radiação UV, que conferem maior estabilidade estrutural.11,32,33 As pequenas variações nos diâmetros dos fios de quitosana, com e sem adição de pó da membrana testácea do ovo, influenciam de forma sutil, mas relevante, na resistência mecânica dos fios. Contudo, fatores como a composição da amostra e o processo de reticulação também interferem significativamente na resistência final, evidenciando o impacto do tratamento químico mesmo com diâmetros semelhantes. Assim, a resistência mecânica dos fios é resultado da interação entre o diâmetro e os processos físico-químicos aplicados à formulação. Fios de biopolímeros fabricados por diferentes metodologias exibem baixa resistência mecânica e grandes variações dimensionais, possivelmente devido à ausência de técnicas de beneficiamento e uniformidade no diâmetro, comprometendo a integridade estrutural.33 Análises biológicas A avaliação de citotoxicidade foi conduzida de acordo com a norma ISO 10993-5,22 que estabelece um valor mínimo de viabilidade celular de 70% para materiais que serão utilizados em contato com tecidos biológicos, com resultados expostos na Figura 4.
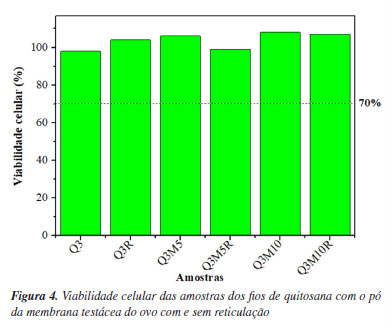
Os resultados obtidos para todas as amostras indicam viabilidade celular acima do limite exigido pela norma. Esses resultados sugerem que todas as amostras apresentam biocompatibilidade, indicando potencial para aplicações biomédicas, como em fios de sutura absorvíveis.34 Amostras contendo maiores quantidades de pó da membrana testácea do ovo, como Q3M5 e Q3M10, e suas respectivas versões reticuladas (Q3M5R e Q3M10R), apresentaram viabilidades celulares superiores. Esse aumento na viabilidade celular pode ser atribuído à presença de componentes bioativos no pó da membrana testácea do ovo, como o colágeno, que podem ter um efeito positivo sobre a proliferação celular. Em particular, a amostra Q3M10R, que contém 10% de pó de membrana testácea e foi submetida ao processo de reticulação com riboflavina e luz UV, demonstrou uma viabilidade celular de 107%, indicando que o processo de reticulação não prejudicou a compatibilidade celular. Esse dado é especialmente relevante, pois a reticulação visa aumentar a estabilidade mecânica e a resistência do material sem comprometer a biocompatibilidade.35 As amostras reticuladas (Q3R, Q3M5R e Q3M10R) mantiveram viabilidade celular superior a 99%, reforçando a hipótese de que a reticulação com riboflavina/luz UV promove aumento da estabilidade estrutural dos fios sem desencadear respostas indesejadas, sendo, portanto, uma abordagem promissora para o desenvolvimento de biomateriais imunocompatíveis. Esse perfil de biocompatibilidade, aliado à preservação das propriedades bioativas do material, pode favorecer a resposta biológica in vivo, promovendo um ambiente celular mais propício à regeneração tecidual e, consequentemente, contribuindo para uma cicatrização mais eficiente e controlada.36 Os resultados das análises de intumescimento para as diferentes amostras, presentes na Figura 5, revelam uma variação significativa nos valores, com uma tendência de diminuição no grau de intumescimento à medida que a quantidade de pó de membrana testácea do ovo aumenta e com o processo de reticulação. A amostra Q3, composta exclusivamente por quitosana, apresentou o maior grau de intumescimento (720%), enquanto a amostra com maior quantidade de pó da membrana testácea e submetida ao processo de reticulação (Q3M10R) obteve o menor valor (590%).
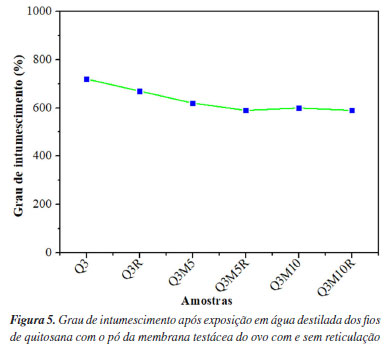
A redução do grau de intumescimento das amostras contendo pó de membrana testácea do ovo pode ser atribuída à diminuição da hidrofilicidade e também das interações ocorridas entre os grupos químicos da quitosana resultante da mistura destes materiais. O pó da membrana testácea do ovo contém componentes que limitam a capacidade de absorção de água da matriz polimérica, como proteínas estruturais e minerais que conferem características menos hidrofílicas. Esse efeito é particularmente visto nas amostras Q3M5 e Q3M10, que possuem 5 e 10% de pó de membrana, respectivamente, e apresentaram valores de intumescimento de 620 e 600%.37 A presença de reticulação, obtida pela combinação de riboflavina e luz UV, também contribuiu para a diminuição do grau de intumescimento. As amostras reticuladas (Q3R, Q3M5R e Q3M10R) mostraram uma redução na capacidade de intumescimento em comparação com as amostras não reticuladas correspondentes. O processo de reticulação forma ligações cruzadas entre as cadeias de quitosana e o colágeno presente no pó da membrana testácea do ovo, o que restringe a expansão da rede polimérica em meio aquoso e reduz a absorção de água. Esse fenômeno é especialmente relevante para a amostra Q3R, onde o intumescimento reduziu de 720 para 670% após a reticulação. Nas amostras contendo pó da membrana testácea do ovo, a reticulação resultou em uma redução menor, mas ainda significativa, com as amostras Q3M5R e Q3M10R apresentando valores de 590%.38 Esses resultados indicam que o grau de intumescimento pode ser controlado pela modificação da composição do material e pelo processo de reticulação. Para aplicações em suturas absorvíveis, essa característica é particularmente vantajosa, pois permite o ajuste da absorção de água e, consequentemente, da taxa de degradação do material no organismo, o que é essencial para garantir o suporte mecânico necessário ao tecido em regeneração durante o tempo adequado. O controle do intumescimento, associado à biocompatibilidade observada nas análises de citotoxicidade, torna essas formulações promissoras para o desenvolvimento de biomateriais funcionais, com potencial para aplicações em suturas e outras interfaces biomédicas que requeiram um equilíbrio entre estabilidade mecânica e absorção controlada. Os índices de biodegradação obtidos após 21 dias de exposição em fluido corporal simulado evidenciaram diferenças significativas no comportamento das amostras, expressas pela perda de massa relativa (%), conforme demonstrado na Figura 6. A amostra Q3, composta apenas por quitosana, apresentou a menor taxa de perda de massa, indicando maior resistência à degradação hidrolítica e, portanto, maior estabilidade frente à biodegradação. Em contrapartida, a amostra reticulada Q3R exibiu um aumento da taxa de degradação, sugerindo que o processo de reticulação com riboflavina sob radiação UV pode induzir modificações na matriz polimérica que facilitam sua hidrólise em meio fisiológico.
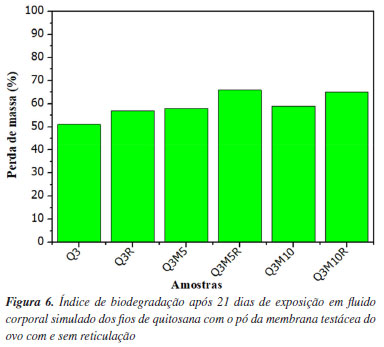
A adição do pó da membrana testácea do ovo, rica em colágeno, nas concentrações de 5% (Q3M5) e 10% (Q3M10), promoveu um aumento da biodegradação em comparação à quitosana pura (Q3). No entanto, não se observaram diferenças estatisticamente significativas entre as concentrações testadas, o que indica que a simples incorporação do material proteico já é suficiente para alterar a estabilidade da matriz. Por outro lado, a reticulação das amostras contendo pó de membrana (Q3M5R e Q3M10R) resultou em um efeito sinérgico, com aumento adicional da taxa de degradação, provavelmente associado à modificação das interações intermoleculares entre a quitosana e o colágeno presente na membrana testácea do ovo durante o processo de reticulação. Os resultados demonstram que tanto o processo de reticulação quanto a concentração do pó da membrana testácea do ovo influenciam de maneira significativa a modulação da biodegradabilidade dos fios. Essa estratégia representa uma abordagem promissora para o ajuste controlado da taxa de degradação conforme a aplicação pretendida, como em suturas absorvíveis ou biomateriais temporários. Portanto, faz-se necessário incluir em estudos futuros uma curva de degradação ao longo do tempo (ex. dias ou semanas), correlacionando a perda de massa com o tempo de exposição in vivo. Essa abordagem permitirá determinar com mais precisão a janela terapêutica de suporte estrutural oferecida pelos fios, essencial para aplicações que demandam controle rigoroso da cinética de degradação.
CONCLUSÕES Este estudo demonstrou que a incorporação de pó da membrana testácea do ovo e o processo de reticulação com riboflavina e luz UV são estratégias eficazes para melhorar as propriedades estruturais e funcionais de fios de quitosana destinados a aplicações biomédicas. A análise por FTIR confirmou a formação de interações intermoleculares e novas ligações cruzadas entre quitosana e o colágeno presente na membrana testácea do ovo, resultando em uma rede polimérica mais coesa e estável. A presença de bandas características das amidas I, II e III corroborou a manutenção da integridade estrutural do colágeno, enquanto a formação de grupos imina (C=N) e a intensificação das bandas em 1060 cm-1 evidenciaram o impacto positivo da reticulação nas propriedades químicas e estruturais do material. A análise morfológica revelou que os fios reticulados apresentaram superfícies mais densas e uniformes, características fundamentais para aplicações como suturas. A adição de 5% de pó da membrana testácea do ovo (Q3M5R) melhorou a integridade dimensional e reforçou as propriedades mecânicas, enquanto o aumento para 10% (Q3M10) resultou em redução na resistência à tração, destacando a importância do equilíbrio entre os componentes para otimizar o desempenho do material. Os resultados de resistência à tração demonstraram que a reticulação é um fator importante para o fortalecimento da matriz quitosana. Fios reticulados, como o Q3R e Q3M5R, apresentaram aumentos significativos de resistência à tração em comparação com as amostras não reticuladas, aproximando-se dos requisitos estabelecidos pela norma ABNT NBR 13904/2003 para fios absorvíveis tipo 3-0. A composição química analisada por EDS confirmou o aumento de nitrogênio nas amostras reticuladas, corroborando a formação de ligações cruzadas, enquanto a presença de cálcio nas amostras com pó de membrana destacou o potencial bioativo do material, especialmente relevante para aplicações que demandam integração com tecidos biológicos. Portanto, este trabalho demonstra que a combinação de quitosana com pó da membrana testácea do ovo e o uso de reticulação são estratégias promissoras para o desenvolvimento de biomateriais avançados, com propriedades mecânicas, químicas e morfológicas ajustadas para aplicações em suturas e outros dispositivos biomédicos. A otimização do processo e a exploração de novas concentrações de componentes podem ampliar ainda mais o potencial de aplicação destes materiais em biomedicina.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados gerados e analisados durante este estudo estão integralmente apresentados no corpo do manuscrito.
AGRADECIMENTOS Os autores expressam sua gratidão ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brasil) e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES, Brasil) pelo apoio financeiro. Também estendemos nossos agradecimentos à Universidade Federal de Campina Grande (UFCG, PB, Brasil) e ao Laboratório de Avaliação e Desenvolvimento de Biomateriais do Nordeste (CERTBIO) pelo inestimável apoio na execução deste trabalho.
CONTRIBUIÇÕES DO AUTOR Lucas C. Oliveira foi responsável por conceituação, análise formal, pesquisa, validação, visualização, redação (rascunho original, revisão e edição); Igor M. Castro por pesquisa, validação, visualização, redação (rascunho original); Taynah P. Galdino por curadoria de dados, pesquisa; Albaniza A. Tavares por conceituação, análise formal, redação (revisão e edição); Suédina Maria L. Silva por administração de projetos; Marcus Vinícius L. Fook por conceituação, administração de projetos; Rossemberg C. Barbosa por conceituação, análise formal, administração de projetos, redação (revisão e edição).
REFERÊNCIAS 1. Alamgir, W.; Haider, A.; Life Sci. 2023, 4, 2. [Crossref] 2. Irastorza, A.; Zarandona, I.; Andonegi, M.; Guerrero, P.; de la Caba, K.; Food Hydrocolloids Health 2021, 116, 106633. [Crossref] 3. Joyce, K.; Fabra, G. T.; Bozkurt, Y.; Pandit, A.; Signal Transduction Targeted Ther. 2021, 6, 122. [Crossref] 4. Budiarso, I. J.; Rini, N. D.; Tsalsabila, A.; Birowosuto, M. D.; Wibowo, A.; ACS Biomater. Sci. Eng. 2023, 9, 3084. [Crossref] 5. Petroni, S.; Tagliaro, I.; Antonini, C.; D'Arienzo, M.; Orsini, S. F.; Mano, J. F.; Brancato, V.; Borges, J.; Cipolla, L.; Mar. Drugs 2023, 21, 147. [Crossref] 6. Fladerer, J. P.; Grollitsch, S.; Bone Rep. 2024, 21, 101776. [Crossref] 7. Shakir, S. U.; Khan, H.; Khan, A. A.; Pharm. Sci. Commun. 2023, 2, 1. [Crossref] 8. Du, J.; Hincke, M. T.; Rose-Martel, M.; Hennequet-Antier, C.; Brionne, A.; Cogburn, L. A.; Nys, Y.; Gautron, J.; BMC Genomics 2015, 16, 792. [Crossref] 9. Ray, S.; Adelnia, H.; Ta, H. T.; Biomater. Sci. 2021, 9, 5714. [Crossref] 10. Wang, H.; Polymers 2023, 15, 3999. [Crossref] 11. Castellano, M.; Dodero, A.; Scarfi, S.; Mirata, S.; Pozzolini, M.; Tassara, E.; Sionkowska, A.; Adamiak, K.; Alloisio, M.; Vicini, S.; Polymers 2023, 15, 2931. [Crossref] 12. Ding, H.; Li, B.; Jiang, Y.; Liu, G.; Pu, S.; Feng, Y.; Jia, D.; Zhou, Y.; Carbohydr. Polym. 2021, 251, 117101. [Crossref] 13. Ding, H.; Li, B.; Liu, Z.; Liu, G.; Pu, S.; Feng, Y.; Jia, D.; Zhou, Y.; Carbohydr. Polym. 2021, 252, 117143. [Crossref] 14. Fu, S.; Zhou, L.; Zeng, P.; Fu, S.; Fibers Polym. 2022, 23, 315. [Crossref] 15. Diniz, C. M. G. P.; Buriti, J. S.; Barbosa, R. C.; Fook, M. V. L.; Rev. Mater. 2019, 24, 1. [Crossref] 16. Deilami, A.; Niknam, Z.; Golchin, A.; Niazi, V.; Zali, H.; Omidi, M.; Polym. Bull. 2022, 79, 39711. [Crossref] 17. Mensah, R. A.; Salim, K.; Peszko, K.; Diop, S.; Wong, T. H.; Chau, D. Y.; Biomed. Mater. 2023, 18, 042001. [Crossref] 18. Mensah, R. A.; Trotta, F.; Briggs, E.; Sharifulden, N. S.; Silva, L. V. B.; Keskin-Erdogan, Z.; Diop, S.; Kureshi, A. K.; Chau, D. Y.; J. Funct. Biomater. 2023, 14, 450. [Crossref] 19. Notario-Pérez, F.; Martín-Illana, A.; Cazorla-Luna, R.; Ruiz-Caro, R.; Veiga, M. D.; Mar. Drugs 2022, 20, 396. [Crossref] 20. Sousa, W. J. B.; Fook, M. V. L.; Lima, E. P. N.; Jesus, R. A.; Melo, I. G.; Lima, V. A. O.; Queiroz, S. F. A. M.; Santos, A. C. Q.; Vieira, C. E. D.; Cavalcanti, C. G.; Oliveira, L. C.; Nascimento, D. M.; Fook, B. R. P. L.; Galdino, T. P.; Farias, R. I. R.; BR 1020210047801, 2021. 21. ASTM F1635-11: Standard Test Method for in vitro Degradation Testing of Hydrolytically Degradable Polymer Resins and Fabricated Forms for Surgical Implants, Philadelphia, 2011. 22. ISO 10993-5: Biological Evaluation of Medical Devices - Part 5: Tests for in vitro Cytotoxicity, ISO: Geneva, 2009. 23. Carlos-Salazar, M. J.; Vega-Chacón, J. R.; Martins, V. C. A.; Plepis, A. M. G.; Rev. Soc. Quim. Peru 2023, 89, 104. [Crossref] 24. Grabska-Zielińska, S.; Pin, J. M.; Kaczmarek-Szczepańska, B.; Olewnik-Kruszkowska, E.; Sionkowska, A.; Monteiro, F. J.; Steinbrink, K.; Kleszczyński, K.; Polymers 2022, 14, 1818. [Crossref] 25. Gieroba, B.; Przekora, A.; Kalisz, G.; Kazimierczak, P.; Song, C. L.; Wojcik, M.; Ginalska, G.; Kazarian, S. G.; Sroka-Bartnicka, A.; Mater. Sci. Eng., C 2021, 119, 111634. [Crossref] 26. Cutini, M.; Ugliengo, P.; J. Chem. Phys. 2021, 155, 075102. [Crossref] 27. Miao, Y.; Liu, J.; Akella, S. S.; Wang, J.; Li, S.; Chuck, R. S.; Zhang, C.; Translational Vision Science & Technology 2022, 11, 2. [Crossref] 28. Associação Brasileira de Normas Técnicas (ABNT); ABNT NBR 13904: Fios para Sutura Cirúrgica - Requisitos e Métodos de Ensaio, ABNT: Rio de Janeiro, 2003. 29. Lv, X.; Lai, L.; Xu, Y.; Sun, M.; Li, Y.; Song, Y.; Wang, N.; Zhang, F.; PLoS One 2023, 18, e0279111. [Crossref] 30. Cestari, F.; Agostinacchio, F.; Galotta, A.; Chemello, G.; Motta, A.; Sglavo, V. M.; Nanomaterials 2021, 11, 264. [Crossref] 31. Park, S.; Gwon, Y.; Kim, W.; Kim, J.; ACS Biomater. Sci. Eng. 2021, 7, 2219. [Crossref] 32. Mathew, S. A.; Arumainathan, S.; ACS Omega 2022, 7, 18732. [Crossref] 33. Andryszczyk, M.; Topoliński, T.; Acta of Bioengineering and Biomechanics 2021, 23, 191. [Crossref] 34. Mensah, R. A.; Cook, M. T.; Kirton, S. B.; Hutter, V.; San Chau, D. Y.; Eur. J. Pharm. Biopharm. 2023, 190, 258. [Crossref] 35. Rohmadi, R.; Harwijayanti, W.; Ubaidillah, U.; Triyono, J.; Diharjo, K.; Utomo, P.; Polymers 2021, 13, 3223. [Crossref] 36. Bharadwaz, A.; Jayasuriya, A. C.; Colloids Surf., B 2021, 208, 112094. [Crossref] 37. Sánchez-Cid, P.; Jiménez-Rosado, M.; Romero, A.; Pérez-Puyana, V.; Polymers 2022, 14, 3023. [Crossref] 38. Su, L.; Huang, J.; Li, H.; Pan, Y.; Zhu, B.; Zhao, Y.; Liu, H.; Int. J. Biol. Macromol. 2021, 172, 231. [Crossref]
Editor Associado responsável pelo artigo: Eduardo H. S. Sousa |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Química Nova
Publicações da Sociedade Brasileira de Química
Caixa Postal: 26037
05513-970 São Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access